Orbitale
 Als Orbitale werden die zeichnerischen Darstellungen der Aufenthaltswahrscheinlickeiten von Elektronen bezeichnet, die man mit Hilfe der Schrödingergleichung berechnen kann (Quadrat der Wellenfunktion). In einem Orbital können sich maximal zwei Elektronen aufhalten.
Als Orbitale werden die zeichnerischen Darstellungen der Aufenthaltswahrscheinlickeiten von Elektronen bezeichnet, die man mit Hilfe der Schrödingergleichung berechnen kann (Quadrat der Wellenfunktion). In einem Orbital können sich maximal zwei Elektronen aufhalten.
Die für uns wichtigsten Orbitale sind die ...
- kugelförmigen s-Orbitale ,
- die hantelförmigen (keulenförmigen, sanduhrförmigen) p-Orbitale und
- die sogenannten Hybridorbitale, die auch hantelförmig sind, wobei jedoch eine Hantel wesentlich kleiner ist.
 Die Form eines Orbitals wird durch die sogenannte Nebenquantenzahl (l) ausgedrückt. Die Hautpquantenzahl (m) gibt die Energiestufe des Elektrons an. Sie entspricht vergleichsweise der Periodenzahl, also der entsprechenden Schale auf der sich nach Bohr die Elektronen befinden. Die Hauptquantenzahl wird der Nebenquantenzahl vorangestellt.
Die Form eines Orbitals wird durch die sogenannte Nebenquantenzahl (l) ausgedrückt. Die Hautpquantenzahl (m) gibt die Energiestufe des Elektrons an. Sie entspricht vergleichsweise der Periodenzahl, also der entsprechenden Schale auf der sich nach Bohr die Elektronen befinden. Die Hauptquantenzahl wird der Nebenquantenzahl vorangestellt.
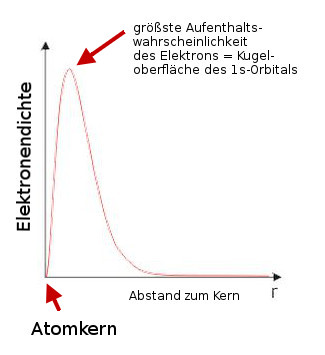
1s-Orbital eines Kohlenstoffatoms:![]()
2s-Orbital eines Kohlenstoffatoms:
Das s-Orbital eines Wasserstoffatoms wird in Folge als weiße Kugel dargestellt.

Ein Elektron, das sich in einem Orbital aufhält, führt keine Rotation um den Atomkern aus. Man muss sich also (als Oberstufenschüler) von der Vorstellung des Bohrschen Atommodells verabschieden. Sowohl die wahrscheinliche Position, als auch der Impuls lassen sich nur mit einer Unschärfe angeben.
Ein Elektron in einem Orbital hat jedoch auch eine kinetische Energie, es befindet sich also nicht vollständig in Ruhe. Dennoch ist die Darstellung eines Orbitals, dass man sich als Ladungswolke vorstellen kann, für viele Betrachtungen - wie z.B. Atombindungen zustande kommen - das modernste Modell.