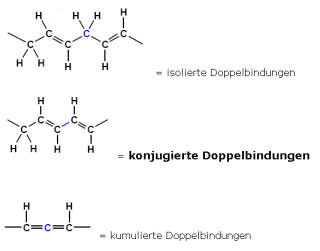
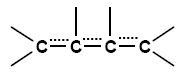Mesomerie am Beispiel von 1,3-Butadien
Zunächst eine Begriffsklärung:
Der Begriff der Mesomerie wurde 1933 von INGOLD im deutschen Sprachbereich eingeführt. Der gleichbedeutende Begriff Resonanz wurde von PAULING im Rahmen der Valence-bond-Methode geprägt.
Bedeutung bzw. Anwendung der Mesomerie:
- Bei der Deutung der Lichtabsorption von Farbstoffmolekülen.
- Bei der Syntheseplanung, um abzuschätzen, an welchen Stellen eines Moleküls eine bestimmte Reaktion erfolgen können (z.B. Zweitsubstitution an Benzolringen).
- Bei der Abschätzung der Stabilität von Verbindungen.
Die Stabilität ist umso größer
- Je größer die Zahl ähnlicher Grenzformeln ist
- Je kleiner die Zahl der formalen Ladungen ist
- Je weiter formale Ladungen des gleichen Vorzeichens voneinander entfernt sind
- Je mehr die Verteilung von formalen Ladungen der Elektronegativität des Atoms entspricht

Als Mesomerie (Resonanz) wird die Erscheinung bezeichnet, dass die in einem Molekül (oder mehratomigen Ion) vorliegenden Bindungsverhältnisse nicht durch eine einzige Strukturformel dargestellt werden können, sondern nur durch mehrere fiktive Grenzformeln (Mesomerieformeln) bzw. Grenzformen, gewissermaßen Extremfälle, die durch Umlagerung von Elektronenpaaren gebildet werden können. Oft treten formale Ladungen auf. Formalladungen werden in einem Kreis geschriebe, Ionenladungen nicht! Die Mesomerieformeln werden mit Hilfe des Mesomeriepfeils unterschieden:![]()
Dies ist nicht mit der IsomerieLex zu verwechseln, bei der es sich um unterschiedliche Stoffe handelt.
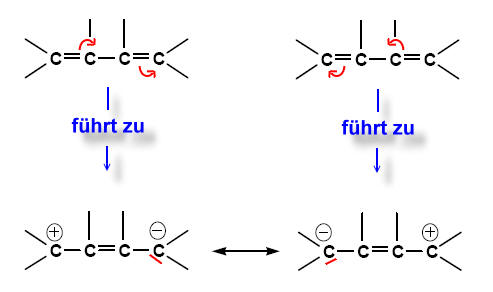
Beispiel: 1,3-Butadien
Zur Namensgebung (Nomenklatur) der Alkene siehe hier.
Man kann sich das so vorstellen:
Um die mesomeren Grenzformen zu erhalten, klappt man konjugierte Doppelbindungen um, ähnlich wie beim Dominoeffekt:

Die beiden "Zwitter-Ionen", die man bei diesen Grenzformen erkennen kann, sind aufgrund der ungleichmäßigen Ladungsverteilung (Elektronenverteilung) energetisch ungünstiger als die uns bekannte "normale" Strukturformel von Butadien; es sind Extremzustände. Trotzdem muss man feststellen, dass keine dieser Formeln die wahre Verteilung der Elektronen eines Butadien-Moleküls charakterisieren.
Dass es sich um Grenzformen handelt wird durch den Mesomeriepfeil (Resonanzpfeil) symbolisiert, der nicht mit dem ein chemisches Gleichgewicht symbolisierenden Doppelpfeil verwechselt werden darf (
![]() ).
).
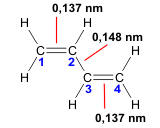
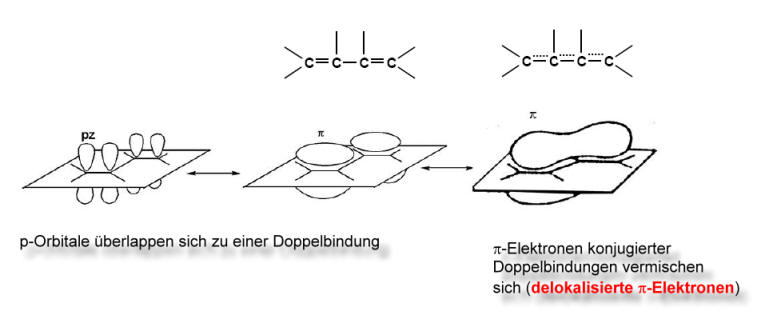
Ein Teil der an der Doppelbindung beteiligten Elektronen, die so genannten π-Elektronen (näheres siehe weiter unten), sind über einen größeren Bereich oder über das ganze Molekül verteilt. Diese verteilten π-Elektronen bezeichnet man als delokalisierte π-Elektronen.
Folgende Formel gibt am ehesten die
tatsächliche Verteilung der π-Elektronen wieder:
Die gestrichelten Linien symbolisieren die delokalisierten, also verteilten, π-Elektronen.
Die Orbitaltheorie erklärt das Vorhandensein von delokalisierten Elektronen so, dass sich die hantelförmigen p-Orbitale überlappen, wodurch die delokalisierten Elektronen sich mit einer größeren Wahrscheinlichkeit in einem größeren Raum "bewegen" können. Auf diese Weise können sich die π-Elektronen über ein ganzes "Kohlenstoffgerüst" verteilen.