Thermodynamische Systeme
Damit Experimente überprüfbar sind, müssen die Bedingungen, unter denen das Experiment stattfindet, exakt beschrieben bzw. festgelegt sein. Man betrachtet deshalb immer nur einen genau begrenzten Teil der Umwelt, den man System nennt.
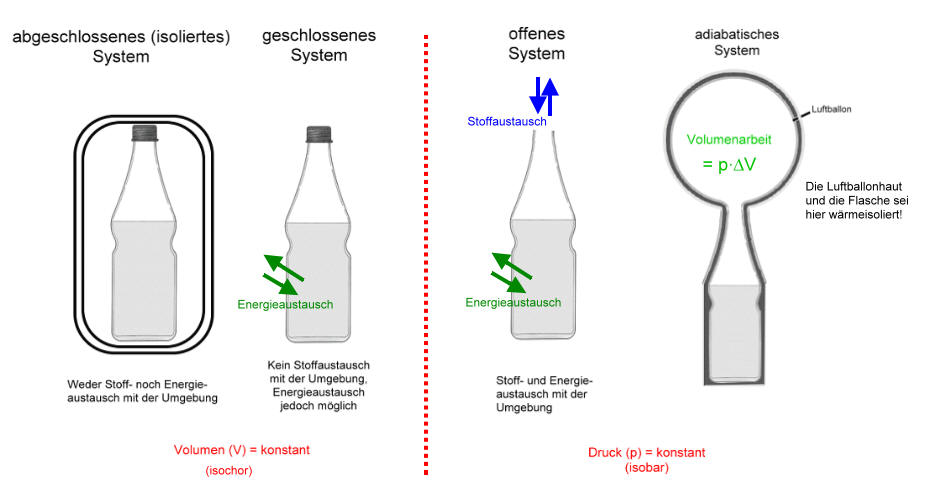
Thermodynamische Systeme am Beispiel einer kohlensäurehaliger Mineralwasser-Flasche
Öffnen wir ein kohlensäurehaltiges Getränk, so entweicht Kohlenstoffdioxid, das hörbar unter Druck stand. Aus Erfahrung wissen wir auch, dass dieser Druck z.B. von der Temperatur abhängig ist. Im gleichen Moment des Öffnens wird das in der Flüssigkeit gelöste Kohlenstoffdioxid durch das Dissoziationsgleichgewicht der Kohlensäure nachgebildet. Das offene System verliert infolge der Gasentwicklung Energie in Form von Volumenarbeit (WVolumen), also mechanischer Arbeit.
Bei einem adiabatischen System ist diese Volumenarbeit sichtbar, denn sie verbleibt im System. Das adiabatische System ist ein geschlossenes System und sollte auch ein isoliertes, also ein abgeschlossenes System im Idealfall sein.
Im chemischen Labor benutzt man für ein abgeschlossenes System ein sogenanntes Bombenkalorimeter. Darin kann man Stoffe verbrennen und ihren Energieinhalt bestimmen.