Synthese von Acetaldehyd im Labor
Im Körper wird Ethanol (Trinkalkohol) zu dem Zwischenprodukt Ethanal "abgebaut". Im Labor kann man Acetaldehyd durch ein geeignetes, mildes Oxidationsmittel ebenfalls aus Ethanol herstellen. Geeignet ist z.B. heißes Kupfer(II)-oxid. Dies kann man ganz einfach gewinnen, indem man Kupfer erhitzt:
Durchführung
Ein Kupferstreifen wird kräftig in der Gasflamme erhitzt.
Beobachtung
Beim Erhitzen von Kupfer entsteht eine schwarze Schicht.
Auswertung
Kupfer wird zu schwarzem Kupfer(II)-oxid oxidiert.
2 Cu + O2 → 2 Cu2+O2-
Kupfer(II)-oxid ist ein mildes Oxidationsmittel und soll nun mit Ethanol reagieren.
 Durchführung
Durchführung
Das heiße Kupfer(II)-oxid wird in Ethanol getaucht (Abzug!)
Beobachtung
Die schwarze Schicht wird wieder kupferfarben; außerdem ist ein
stechender Geruch wahrnehmbar, der vorher nicht da war.
Achtung: Keine Geruchsprobe, da der entstehende Acetaldehyd gesundheitsschädlich ist.
Auswertung
Kupfer(II)-oxid wird zu Kupfer reduziert und es entsteht eine weitere neue Verbindung (neuer Geruch!).
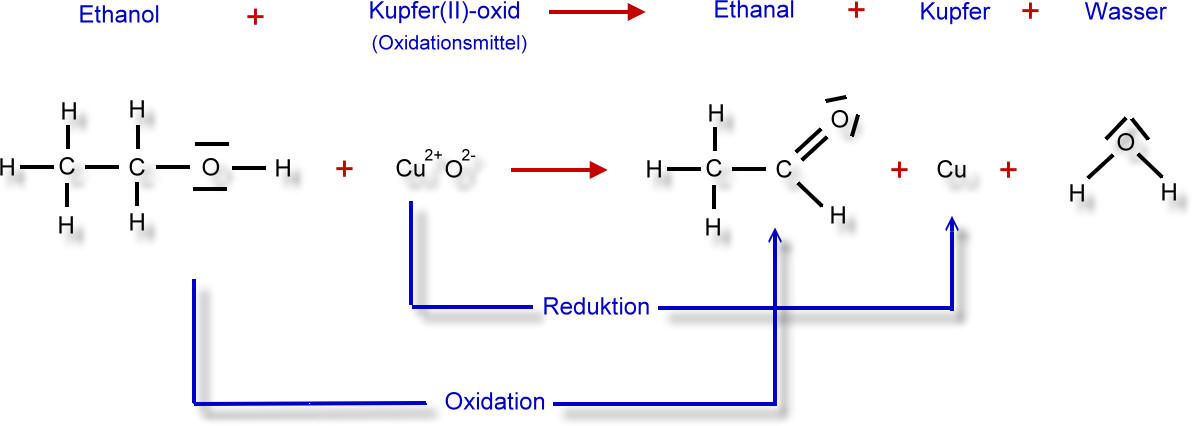
Vollständiges Reaktionsschema in Worten und in Strukturformelschreibweise:
Hier wird also gleichzeitig ein oxidiert und ein anderer Stoff reduziert (Redoxreaktionen):
Kupfer(II)-oxid wird zu elementarem Kupfer reduziert. Heißes Kupfer(II)-oxid ist das Oxidationsmittel. Gleichzeitig wird Ethanol zu Ethanal oxidiert.
Dem Oxidationsprodukt Acetaldehyd fehlen zwei Wasserstoff-Atome. Den Entzug von Wasserstoff nennt der Chemiker auch Dehydrierung. Jetzt wird auch die Herkunft des Namens für die Stoffgruppe deutlich: Lateinisch: Alkohol Dehydrogenatus = Aldehyd.
 Primäre Alkohole lassen sich zu Aldehyde oxidieren.
Primäre Alkohole lassen sich zu Aldehyde oxidieren.
Konflikt:
Vergleicht man die Strukturformeln von Ethanol und Ethanal- so fällt auf, dass das Oxidationsprodukt kein weiteres Sauerstoff-Atom zusätzlich "gewonnen hat". Das Modell – Oxidation = Sauerstoffaufnahme – kann für diese Reaktion nicht angewendet werden. Somit ist auch der Begriff Oxidationsmittel nicht mehr eindeutig.
Bisher:
1. Definition der Oxidation (8. Klasse):
Oxidation bedeutet Sauerstoff-Aufnahme. Ein Stoff, der Sauerstoff-Atome aufnimmt, wird oxidiert. Ein Stoff, der Sauerstoff-Atome abgeben kann nennt man Oxidationsmittel.
Wie sieht es mit der Definition aus der 9. Klasse aus?
2. Definition der Oxidation (9. Klasse)
Oxidation = Elektronenabgabe
("Eselsbrücke": Oxfort - Die berühmte Universität in Großbritannien wird jedoch mit "d" am Ende geschrieben)
Wenn du die Elektronenanzahl in einem Ethanol-Molekül mit der Elektronenanzahl in einem Acetaldehyd-Molekül vergleicht, dann stellst du fest, dass das Acetaldehyd-Molekül zwei Elektronen weniger besitzt.
Es gibt noch eine andere Definition für die Oxidation, die bei vielen Reaktionen einfach anzuwenden ist:
Neue, 3. Definition der Oxidation
Redoxreaktionen sind Elektronenübergangsreaktionen!
Mit Hilfe von Oxidationszahlen kann man erkennen, an welcher Stelle eines Moleküls eine Oxidation bzw. eine Reduktion stattgefunden hat.
Oxidation = Erhöhung der Oxidationszahl
Reduktion = Erniedrigung der Oxidationszahl
Wie man die Oxidationszahl bestimmt, wird im nächsten Artikel beschrieben.