Siedepunkte - Ein Vergleich
Die Diskusion über den Zusammenhang zwischen dem Siedepunkt einer Verbindung und deren MolekülmasseLex haben wir schon mehrmals geführt:
Wie sieht es nun bei den Aldehyden aus?
Betrachten wir hierfür aus jeder Stoffklasse einen Vertreter, dessen Molekularmasse gleich oder ähnlich ist. Bei diesem Vergleich sind demnach die van-der-Waals-Kräfte gleich (geringe Unterschiede in der Größe der Oberfläche der Moleküle können hier vernachlässigt werden).
| Stoff | Summenformel | Molekülmasse | Strukturformel | Modell1 | Sdpkt. |
| Propan | C3H8 | 44 u | 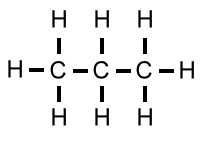 |
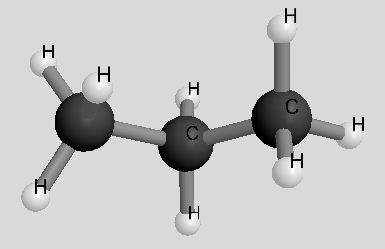 |
- 42°C |
| Ethanol | C2H5OH | 46 u | 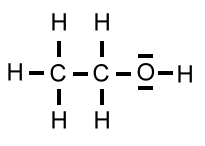 |
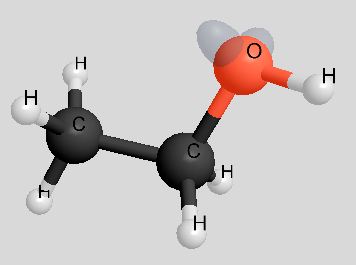 |
78°C |
| Ethanal | CH3CHO | 44 u | 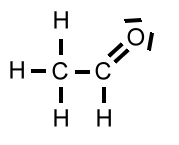 |
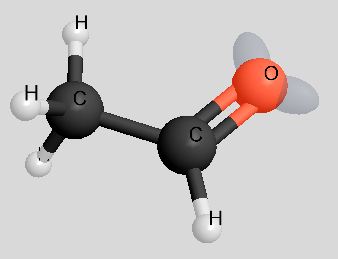 |
20,4°C |
1 Mit den nicht bindenden Elektronenpaaren am Sauerstoff-Atom. Gezeichnet mit dem Struktomat.
Da bei den Propan-Molekülen lediglich die schwachen van-der-Waals-Kräfte wirken, besitzt Propan den niedrigsten Siedepunkt. Er liegt weit unter der Raumtemperatur, Propan ist also bei Raumtemperatur gasförmig.
Ein Vergleich zwischen den Alkoholen und den Aldehyden
Die Molekülmassen von Ethanol und Ethanal sind nahezu gleich, die Berührungsflächen der Moleküle ebenfalls. Demzufolge sind die van-der-Waals-Kräfte auch gleich.
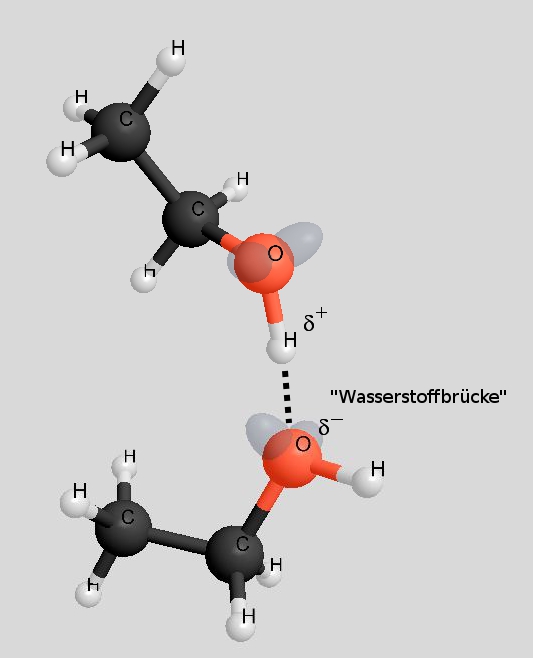
Sowohl Ethanol als auch Ethanal haben funktionelle Gruppen, die polar sind, so dass zwischen den Molekülen Dipol-Dipol-Wechselwirkungen auftreten. So gesehen ist der höhere Siedepunkt von Ethanol auf den ersten Blick unverständlich. Schauen wir uns die Dipol-Dipol-Wechselwirkungen mal genauer an:
Bei der Hydroxy-Gruppe eines Ethanol-Moleküls beträgt die Elektronegativitätsdifferenz ΔH zwischen dem Sauerstoff-Atom und dem Wasserstoff-Atom 1,5. Bei der Carbonyl-Gruppe eines Ethanal-Moleküls beträgt sie 1. Somit sind die Dipol-Dipol-Wechselwirkungen zwischen Ethanol-Molekülen etwas kräftiger. Der entscheidende Punkt ist aber ein anderer:
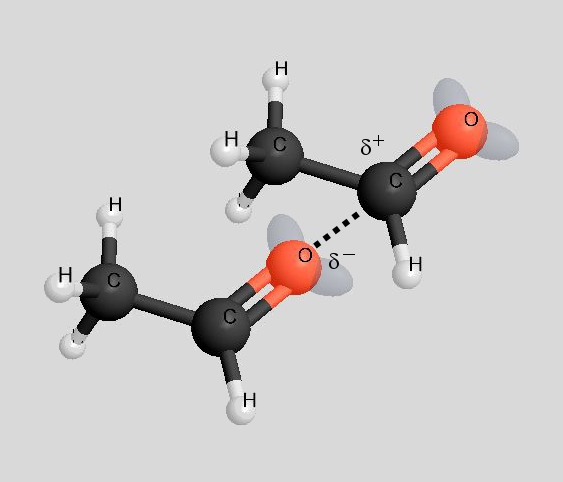
Während bei den Ethanol-Molekülen die "Wasserstoffbrücken" völlig ungehindert ausgebildet werden können, ist die Ausbildung von Dipol-Dipol-Wechselwirkungen zwischen den Ethanal-Molekülen durch den Bau der Moleküle behindert (rechtes Bild).