Acetaldehyd (Ethanal)
Detaillierte Strukturformel
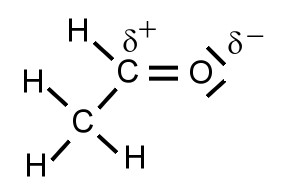
Die Elektronegativitätsdifferenz zwischen einem Kohlenstoff-Atom und einem Sauerstoff-Atom ist größer als 0,5. Daher werden die Bindungselektronen von dem Atom, das die größere Elektronegativität besitzt, also hier Sauerstoff, stärker angezogen. Es entsteht eine polare Atombindung und Partialladungen.
Skelettstrukturformel
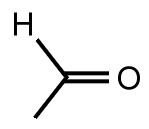
Bei einer Skelettstrukturformel wird das Elementsymbol für ein Kohlenstoff-Atome weg gelassen. Die Kohlenstoff-Atome befinden sich dort, wo die Formel einen Knick macht, am Ende eines Strichs und dort, wo sich Striche kreuzen. Auch das Elementsymbol für Wasserstoff-Atome wird in der Regel nicht gezeichnet; es sei denn, es führt - wie hier - zu einer Verdeutlichung der funktionellen Gruppe. Es werden auch nicht alle Bindungen gezeichnet. Man geht davon aus, dass der Chemiker / die Chemikerin weiß, dass sich an einem Kohlenstoff-Atom vier Bindungen befinden und, wenn nicht anders angegeben, an diesen Bindungen sich Wasserstoff-Atome befinden. Vergleiche auch hierzu die detaillierte Strukturformel von Ethanal.
Modell
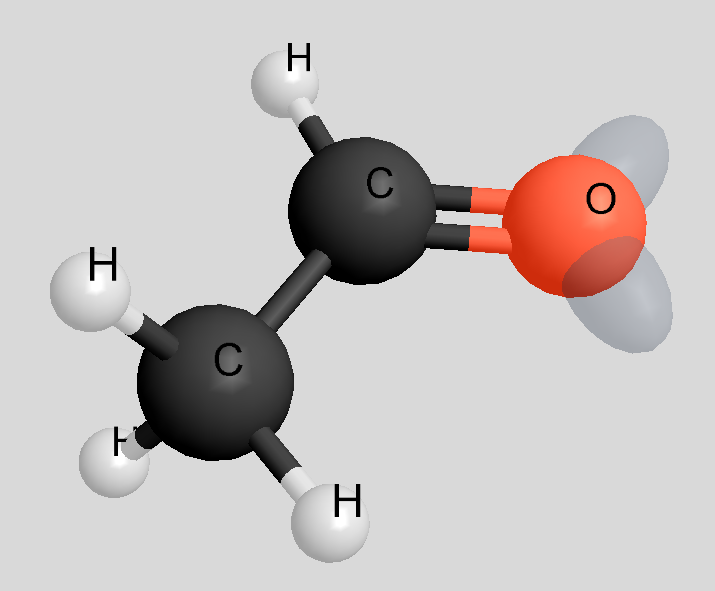 Die transparenten "Beulen" stellen die nicht bindenden Elektronenpaare dar.
Die transparenten "Beulen" stellen die nicht bindenden Elektronenpaare dar.
Mit dem Struktomat gezeichnet.
Summenformel
CH3CHO
Die funktionelle Gruppe der Aldehyde (CHO) wird immer ans Ende der Summenformel gestellt.
Trinkalkohol (Ethanol) wird in der Leber bis zu Kohlenstoffdioxid und Wasser durch Biokatalysatoren abgebaut. Beides atmen bzw. schwitzen wir aus.
Als Zwischenprodukt entsteht allerdings die toxische (giftige) Verbindung Acetaldehyd (systematischer Name: Ethanal). Dieser Stoff ist u.a. auch für den "Kater" verantwortlich.
Eigenschaften



- Siedetemperatur: 20 °C
- Da die Siedetemperatur nahe der normalen Raumtemperatur ist, verdunstet die Flüssigkeit leicht (sie ist sehr leicht flüchtig) und ist daher auch leicht brennbar.
- Die Ethanal-Moleküle, die eine Nase erreichen, verursachen einen charakteristischen, stechenden, fruchtigen Geruch. Ein Warnsignal unseres Körpers!
- Ethanal ist gesundheitsschädlich und steht in dringendem Verdacht bei hoher Konzentration eine krebserzeugende (karzinogene) Wirkung auszulösen.
- Ethanal ist in Wasser unbegrenzt und in unpolaren Lösemitteln leicht löslich.
- Acetaldehyd ist eine hochreaktive Verbindung.
Vorkommen / Verwendung
- Auch Ethanal entsteht bei der Verbrennung von Tabakrauch, wie eben auch Methanal.
- Acetaldehyd ist ein Aromastoff und findet sich in geringen Mengen in alkoholischen Getränken, Röstkaffee und Fruchtaromen wie z.B. frischem Orangensaft. [1]
- Ethanal ist ein wichtiges Zwischenprodukt, aus dem viele andere Stoffe in der chemischen Industrie hergestellt werden: Farben, Parfüme, Konservierungsstoff für Früchte und Fisch und vieles mehr.
 "Alle Dinge sind Gift, und nichts ist ohne Gift, allein die Dosis macht´s, dass ein Ding kein Gift ist."
"Alle Dinge sind Gift, und nichts ist ohne Gift, allein die Dosis macht´s, dass ein Ding kein Gift ist."
Paracelsus (1493-1541)
-------------------------
[1] Quelle: Römpp USB Stick · 2008, ISBN: 978-3-13-149231-9



