Lewis-Formeln und das Orbital-Modell
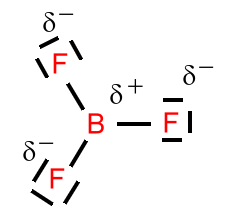 Schauen wir uns noch einmal das Bortrifluorid an. Die LEWIS-Formel unter Berücksichtigung des Elektronenpaarabstoßungs-Modell von GILLESPIE besitzt drei identische Einfachbindungen (siehe aber auch hier). Wenn wir uns die Elektronenkonfiguration im Thermschema anschauen, dann fragt man sich unweigerlich, wie durch eine Überlappung von Orbitalen gleichwertige Bindungen entstehen sollen.
Schauen wir uns noch einmal das Bortrifluorid an. Die LEWIS-Formel unter Berücksichtigung des Elektronenpaarabstoßungs-Modell von GILLESPIE besitzt drei identische Einfachbindungen (siehe aber auch hier). Wenn wir uns die Elektronenkonfiguration im Thermschema anschauen, dann fragt man sich unweigerlich, wie durch eine Überlappung von Orbitalen gleichwertige Bindungen entstehen sollen.
Verkürzte Elektronenkonfiguration:
5B [He] 2s2 2p1
Thermschemata:
|
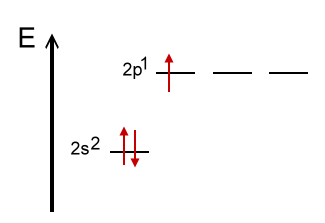
Das Thermschema zeigt die Valenzelektronenkonfiguration eines Bor-Atoms. Die beiden Elektronen im 1s-Orbital sind also hier nicht aufgeführt, da sich bei chemischen Reaktionen nur Veränderungen bei den Valenzelektronen ergeben. Eine Überlappung der p-Orbitale mit Orbitalen des Fluors würde nicht zu 3 gleichwertigen Bindungen führen. Durch Zufügung von Energie kann 1 Elektron aus einem 2s-Orbital auf das py-Orbital angehoben werden. Dieser angeregte Zustand (promoted state) ist im nächsten Thermschema veranschaulicht. |
|
|
Angeregter Zustand eines Bor-Atoms |
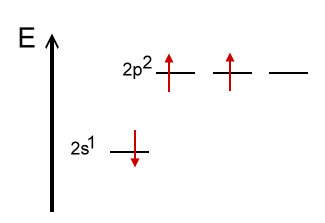
Wir hätten jetzt zwar 3 Orbitale, die jeweils nur mit einem Elektron besetzt sind - aber gleichwertig sind die Orbitale nicht: Ein s-Orbital ist kugelförmig, die p-Orbitale sind keulenförmig. Die 3 einfach besetzten unterschiedlichen Orbitale können sich mischen und damit einen energetisch günstigeren Zustand erreichen. Solche Mischung nennt man Hybridisierung. Die entstehenden, identischen Orbitale heißen Hybrid-Orbitale. |
|
Hybridisierter Zustand |
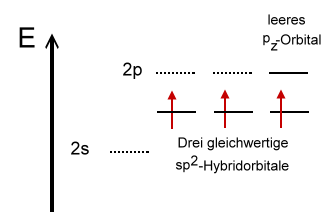
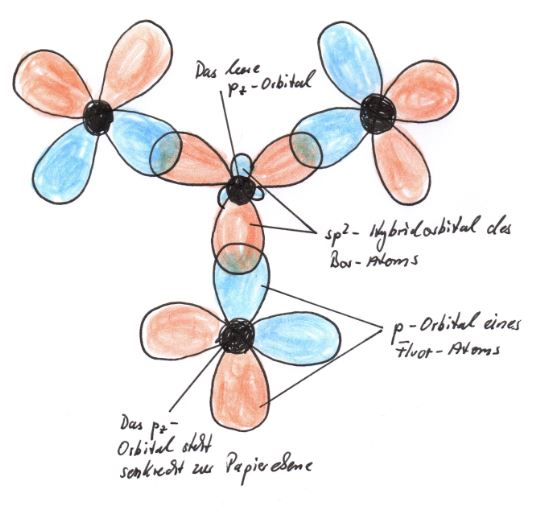
Bei den Hybrid-Orbitalen handelt es sich auch um keulenförmige Orbitale, wobei eine Seite kleiner ist. Die Kennzeichnung sp2-Hybrid-Orbital rührt daher, dass die Mischung aus einem s-Orbital und zwei p-Orbitalen erfolgt ist. Hier ist also nicht die Anzahl an Elektronen gemeint. Die drei sp2-Hybrid-Orbitale des Bors können nun mit Orbitalen der Fluor-Atome durch Überlappung drei gleichwertige Bindungen eingehen. Im hybridisierten Zustand besitzt das Bor-Atom noch ein leeres pz-Orbital. |
|
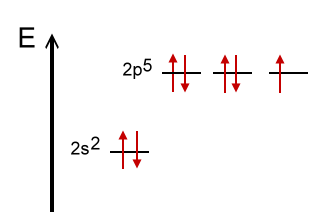
Grundzustand eines Fluor-Atoms |
Die Elektronenkonfiguration eines Fluor-Atoms: 9F [He] 2s2 2p5 und das entstprechende Thermschema machen deutlich, dass Fluor ein pz-Orbital für eine Bindung, also für eine Überlappung mit einem Orbital eines anderen Atoms, zur Verfügung stellen kann. Also überlappen sich jeweils ein p-Orbital eines Fluor-Atoms mit jeweils einem sp2-Hybrid-Orbital des Bor-Atoms.
Die 2s2-Orbitale und die 1s2-Orbitale wurden nicht mit gezeichnet. |
 Einfachbindungen, wie sie hier beim Bortrifluorid-Molekül beschrieben wurden, nennt man Sigma-Bindungen (σ-Bindungen).
Einfachbindungen, wie sie hier beim Bortrifluorid-Molekül beschrieben wurden, nennt man Sigma-Bindungen (σ-Bindungen).