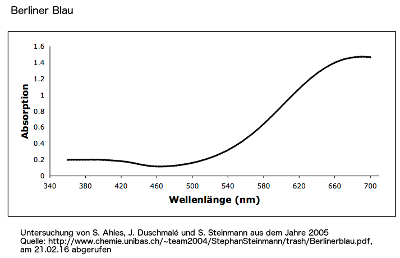
Berliner Blau

Berliner Blau, Eisen(III)-hexacyanoferrat (II), ist eine Metall-Komplexverbindung (Koordinationsverbindung): Fe3+4[Fe2+(CN-)6]3
Exkurs: Metall-Komplexverbindungen
Kennzeichen eines Metallkomplexes ist das Vorhandensein von sogenannten koordinativen Bindungen. Hierbei stellen sogenannte Liganden mit ihren freien Elektronenpaaren jeweils beide Elektronen für die jeweilige Bindung zu einem Metall-Ion zur Verfügung.
Ein Ligand ist also ein Elektronenpaar-Donator, das Metall-Ion ein Elektronenpaar-Akzeptor. Nach der Säure-Base-Theorie von Lewis ist demnach der Ligand eine Lewis-Säure, das Metall-Ion eine Lewis-Base.
Oft erreicht das Zentral-Ion durch die Bildung der koordinativen Bindungen die Edelgaskonfiguration des folgenden Edelgases, da leere Orbitale des Zentral-Ions durch die Elektronenpaare der Liganden aufgefüllt werden.
Die Summenformeln eines Metallkomplexes wird in eckigen Klammern geschrieben, wobei das zentrale Ion an erster Stelle steht. Dann folgen die Liganden (bei Molekülen in runden Klammern). Abschließend wird die Ladung des Komplexes hochgestellt notiert. Die Koordinationszahl gibt an, wieviele Liganden an das Zentral-Ion gebunden sind. Es gibt auch Liganden, die mehrfach am Zentral-Ion gebunden sind. Diese nennt man Chelat-Liganden.
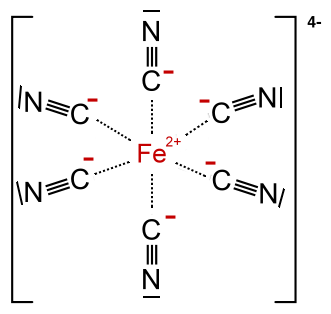
Die Liganden beim Berliner Blau sind Cyanid-Gruppen, die jeweils eine negative Ladung tragen:
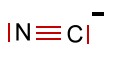 . Die Koordinationszahl beträgt 6.
. Die Koordinationszahl beträgt 6.
Elektronenkonfiguration eines Eisen-Atoms:
Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Elektronenkonfiguration des Eisen-Ions:
Fe2+: 1s2 2s2 2p6 3s2 3p6 3d6
Die 6 Liganden steuern 12 Elektronen bei:
[Fe2+(CN)6]4- : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6
Alle Orbitale sind voll besetzt. Dies entspricht der Elektronenkonfiguration von Krypton.
Da Untersuchungen gezeigt haben, dass die Liganden oktaedrisch, also gleichmäßig um das Zentral-Ion gebunden sind, kann man davon ausgehen, dass 6 energetisch gleichwertige d2sp3-Hybridorbitale gebildet werden.



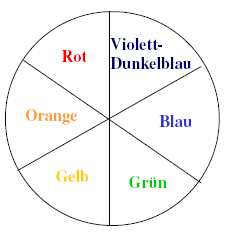
 Es gibt Stoffe, die nehmen aus dem sichtbaren Farbspektrum bestimmte Anteile auf. Der nicht absorbierte Teil des Lichtes addiert sich zur komplementären Eigenfarbe des farbigen Stoffes.
Es gibt Stoffe, die nehmen aus dem sichtbaren Farbspektrum bestimmte Anteile auf. Der nicht absorbierte Teil des Lichtes addiert sich zur komplementären Eigenfarbe des farbigen Stoffes.