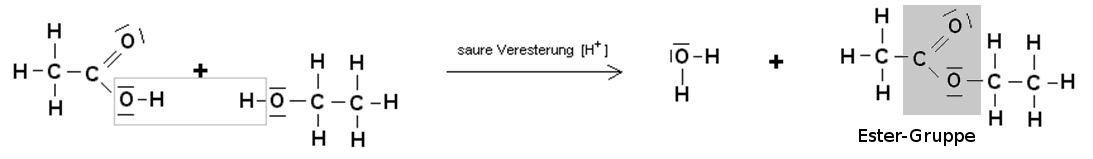
Die Esterbildung am Beispiel von Ethansäureethylester
Wenn Ethansäure mit Ethanol reagiert, so entsteht ein Ester, der sehr stark nach Klebstoffen riecht. Auch wenn dies wenig an Duft- und Aromastoffe erinnert, wird der entstandene Ester (Ethansäureethylester) zur Gruppe der Duft- und Aromastoffe gezählt, weil er aus einem kurzkettigen Alkohol und einer kurzkettigen Carbonsäure gebildet worden ist.
Der Estername wird folgendermaßen gebildet: Carbonsäurename + Alkylrest des Alkohols + ester.
Ethansäure + Ethanol → Wasser + Ethansäureethylester
CH3COOH + CH3CH2OH → H2O + CH3COOCH2CH3
Der Ester, der entsteht, wenn man Ethansäure und Pentan-1-ol reagieren lässt, riecht nach Banane.
Butansäuremethylester riecht nach Ananas, Butansäureethylester nach Pfirsich, Butansäurepentylester nach Birne und Pentansäurepentylester nach Apfel.

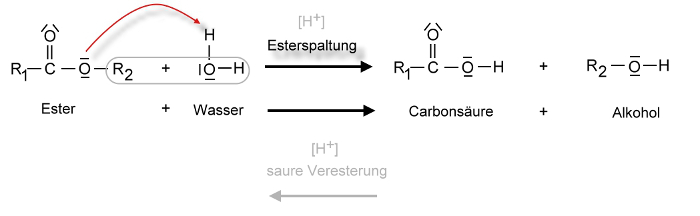
Ester können aus Carbonsäuren und Alkoholen katalytisch hergestellt werden. Die Reaktion nennt man Veresterung. Bei der Veresterung werden zwei Moleküle unter Abspaltung von Wasser miteinander verknüpft. Eine derartige Reaktion bezeichnet man als Kondensationsreaktion. Ester können auch wieder durch Hydrolyse oder Verseifung gespalten werden.
Eine solche Reaktion kann auch in die Richtung der Ausgangsstoffe (Edukte) zurück reagieren. Es stellt sich ein dynamisches Gleichgewicht ein, bei der die Konzentrationen der Ausgangsstoffe und die Konzentrationen der Reaktionsprodukte zu einem bestimmten Verhältnis stehen. Diese Art von Hin- und Rückreaktion kennzeichnet man üblicherweise mit einem Gleichgewichtspfeil (dieser wurde im obigen Reaktionsschema nicht verwendet):
![]()
Im obigen Beispiel reagiert Ethansäure (Essigsäure) mit Ethanol. KatalysatorLex ist Schwefelsäure. Doch Schwefelsäure setzt hier nicht nur die Aktivierungsenergie herab. Schwefelsäure ist hygroskopisch, bindet also gut Wasser. Wenn auf der Seite der Reaktionsprodukte Wasser entzogen wird, so wird das Gleichgewicht gestört. Die Reaktion verläuft dann stärker nach rechts, um das Gleichgewicht wieder herzustellen. Eine erhöhte Ausbeute des Esters ist die Folge.