Hydroxid-Ionen
Misst man mit sehr empfindlichen Messgeräten die elektrische Leitfähigkeit von reinstem Wasser (aqua dest.), so stellt man eine sehr geringe Leitfähigkeit fest. Also müssen auch in reinstem Wasser Ionen vorliegen.
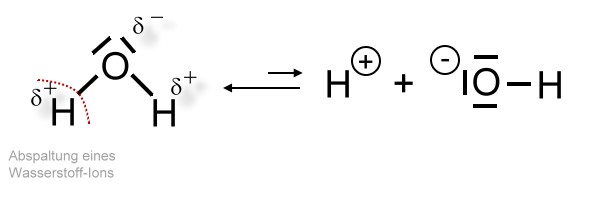
Einige Wassermoleküle spalten ein Wasserstoff-Ion ab. Diesen Vorgang nennt man Autoprotolyse.
Darstellung in Strukturformelschreibweise
Auf diese Weise entstehen sogenannte Hydroxid-Ionen, die einfach negativ geladen sind. Beim Wasser kommt allerdings die Wirkung der Hydroxid-Ionen nicht zur Geltung, da sie von den positiv geladenen Wasserstoff-Ionen, die hier immer in gleicher Anzahl vorliegen, gewissermaßen neutralisiert werden. Mehr dazu bei der Salzbildungsart "Neutralisationsreaktion".
Befinden sich Hydroxid-Ionen (im Überschuss) im Wasser, so spricht man von einer Lauge oder von einer alkalischen Lösung.
Die Hydroxid-Ionen sind die eigentlichen "Laugen-Teilchen", die für alle Eigenschaften der Laugen verantwortlich sind. Sie liegen im Wasser hydratisiert vor: OH-(aq).
Bei den Säuren sind es die Wasserstoff-Ionen (nach Arrhenius) bzw. die Oxonium-Ionen (nach Brönsted), die für alle Säureeigenschaften verantwortlich sind.
Der Begriff alkalische Lösung rührt daher, dass Metallhydroxide Laugen bilden und die in den Metallhydroxiden enthaltenen Metall-Ionen meistens Alkalimetall-Ionen sind (die Elemente der I. Hauptgruppe heißen Alkalimetalle).
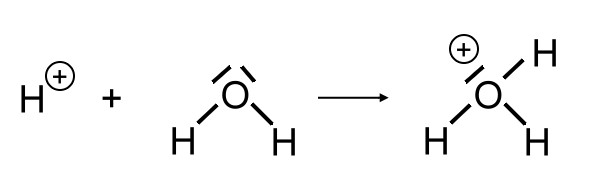
Der Vollständigkeit halber soll hier auch noch ausgeführt werden, dass das entstehende Wasserstoff-Ion mit einem weiteren Wassermolekül zu einem Oxonium-Ion (H3O+) reagiert: