Beiträge
- intro (3)
- Uncategorised (14)
-
Inhalt
(0)
-
Allgemeines
(2)

Dieser Unterrichtsblock "Allgemeines" beinhaltet hilfreiche Informationen, die du in jeder Klassenstufe gebrauchen kannst.
Registrierte LehrerInnen
oder sonst fachlich Interessierte
haben zusätzliche Angebote zur Verfügung ... -
Basic 1
(0)

Basic 1
Chemie ist Zauberei, denn der Chemiker stellt neue Stoffe aus anderen Stoffen her.Beispiel:
Aus dem extrem reaktionsfreudigen Metall Natrium, das in Wasser heftig explodiert, und Chlor, ein Kampfgas im 1. Weltkrieg, kann der Chemiker Kochsalz herstellen, das für uns lebensnotwendig ist und nichts mehr mit den Ausgangsstoffen zu tun hat.
Bei chemischen Reaktionen entstehen völlig neue Stoffe, die nichts mehr mit den Ausgangsstoffen zu tun haben.
Um zu verstehen, warum Stoffe miteinander zu neuen Stoffen mit völlig neuen Eigenschaften reagieren, müssen wir die Ausgangsstoffe besser verstehen und letztendlich ihren inneren Aufbau begreifen. Dies wird ein langer Weg sein. Der Unterrichtsblock "Von den Anfängen bis zu einem brauchbaren Atommodell" ist Grundlage dafür, das Phänomen (Schauspiel) zu verstehen, warum sich bestimmte Stoffe miteinander zu neuen Stoffen "verbinden".-
Das Labor
(0)
Das Labor

Orientierung
Einführung

Advanced Organizer
Wenn du weißt, wie die Laborgeräte heißen und in welchem Zusammenhang man sie benutzen kann, ist das ein großer Vorteil, um Experimente selbstständig durchzuführen.
Das Experimentieren mit Chemikalien birgt auch Gefahren. Du musst lernen, diese Gefahren richtig einzuschätzen und, wie du dich beim Experimentieren am besten verhältst.
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links- Die Sicherheits- und Experimentierregeln kennen und sie sicher beim Experimentieren anwenden können.
- Wichtige Laborgeräte und deren Anwendungsmöglichkeiten kennen.
 Optional:
Optional:
- Glasrohre bearbeiten können (Glasbläserarbeiten).
- Lösungen herstellen können.
- Bestandteile von Gemischen durch physikalische Methoden isolieren können.
- Sicherheit (1)
- Gefahrensymbole / Gefahrenpiktogramme (2)
- Laborgeräte (4)
- Laborführerschein (1)
-
Trennung von Stoffgemischen
(1)
Das Labor

Trennung von Stoffgemischen
Dieses Thema ist nur zu verstehen, wenn zuvor das Kapitel "Stoffe", insbesondere das Thema "Einteilung der Stoffe (1)", gelernt wurde.
- Herstellung von Lösungen (1)
- Die Sicherheits- und Experimentierregeln kennen und sie sicher beim Experimentieren anwenden können.
-
Stoffe
(0)
Stoffe (1)

Orientierung
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - LinksFachbegriffe, Personen
Fachbegriffe, Definitionen, Personen
- Die Ansichten der ersten Naturphilosophen und das Atommodell von Demokrit und Dalton kennen
Phänomene
Gesetzmäßigkeiten anwenden, Phänomene deuten, Reaktionsschemata aufstellen (Summenformeln, Ionenformelschreibweise, Strukturformeln)
- Das Teilchenmodell beschreiben und erläutern können, insbesondere im Hinblick auf die Aggregatzustände
Zusammenhänge
Vorgänge, Zusammenhänge, Funktionsweisen (im Zusammenhang mit der Bedeutung für Mensch, Tier, Pflanze und Umwelt) bewerten
- Den Stellenwert der Chemie in der Gesellschaft begreifen
- Stoffe in einem Schema ordnen können (Grobeinteilung: Reinstoff, Gemisch, Verbindung, Element, Metall, Nichtmetall)
- Womit beschäftigt sich die Chemie? (4)
-
Stoffe und deren Eigenschaften
(1)
Stoffe (1)

Stoffe und deren Eigenschaften
Unterschiedliche Stoffe besitzen auch unterschiedliche Eigenschaften. Noch besser ausgedrückt: Unterschiedliche Stoffe unterscheiden sich in mindestens einer Eigenschaft. Der Chemiker beschreibt solche Eigenschaften so genau wie möglich. Ändern sich die Eigenschaften eines Stoffes, so ist das ein Hinweise auf eine Stoffumwandlung (chemische Reaktion), bei der mindestens ein neuer Stoff entsteht. Allerdings sind viele Eigenschaften nicht gleich offensichtlich, sondern müssen durch Experimente bestimmt werden.
Der Aggregatzustand (fest, flüssig und gasförmig) eines Stoffes ist keine Eigenschaft eines Stoffes, sondern ein Zustand. Dieser Zustand ist von der Temperatur und vom Druck (z.B. Luftdruck) abhängig. Zustandsänderungen sind also kein Beweis für eine chemische Reaktion.
Die Schmelz- und Siedetemperatur eines Stoffes sind hingegen typische Eigenschaften von Stoffen.
- Stoffe bestehen aus Teilchen - Ein Modell (2)
- Stoffteilchenmodell - genauer betrachtet (2)
- Demokrit und Dalton (5)
- Einteilung der Stoffe (1) (2)
- Test zum Kapitel Stoffe (2)
-
Feuer / Verbrennung
(0)
Feuer / Verbrennung / Sauerstoff

Orientierung
Einführung

Advanced Organizer
Mit Hilfe des letzten Kapitels "Stoffe" hast du eine ungefähre Vorstellung davon, woraus Stoffe bestehen: Nämlich aus Teilchen. Das Teilchenmodell gab eine brauchbare Erklärung für die Aggregatzustände von Stoffen.
Wir haben im letzten Kapitel auch gesehen, dass Stoffe stofftypische Eigenschaften besitzen. Für den Chemiker sind aber nicht nur Stoffeigenschaften interessant: Die Chemie beschäftigt sich vor allem mit Stoffumwandlungen. Und darum soll es in diesem Kapitel gehen.
Schon lange vor Christi Geburt war bekannt, dass man mit Hilfe von Feuer andere Stoffe herstellen kann. Noch im 17. und 18. Jahrhundert versuchten die Alchemisten aus unedlen Metallen Gold herzustellen.
Die Verbrennung (Oxidation) von bestimmten Stoffen liefert bei Anwesenheit von ausreichend Sauerstoff neue Stoffe. Diese neu entstandene Stoffe werden mit allgemeinem Namen Reaktionsprodukte genannt. Reaktionsprodukte, die durch Oxidation entstanden sind, werden Oxide genannt. Je nachdem, ob man Metalle oder Nichtmetalle verbrennt, erhält man Metalloxide bzw. Nichtmetalloxide.
Wir werden sehen: Das Entstehen von neuen Stoffen kann man durch Beobachten von Eigenschaftsänderungen feststellen. Dabei is es jedoch wichtig, Ausgangsstoffe (Edukte) und Reaktionsprodukte unter gleichen Bedingungen zu vergleichen. Außerdem werden wir feststellen, dass unterschiedliche Metalle eine unterschiedliche Affinität (Zuneigung) haben mit Sauerstoff zu reagieren. Und wir werden feststellen, dass alle Oxidationen Energie liefern (exotherme Reaktion).Doch fangen wir am Anfang an ...
Alles begann in der Chemie mit dem Feuer...
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links-
...
Phänomene
Gesetzmäßigkeiten anwenden, Phänomene deuten, Reaktionsschemata aufstellen (Summenformeln, Ionenformelschreibweise, Strukturformeln)
- ...
- Was ist Feuer? (4)
- Sauerstoff (5)
- Die Oxidation (2)
- Oxidationsreihe der Metalle (3)
- Chemische Reaktionen erkennen (3)
- Energieumsatz (1)
-
-
Nichtmetalle - und deren Oxide
(0)
Nichtmetalle - und deren Oxide

Orientierung
Einführung
Advanced Organizer
Im Mittelpunkt des letzte Kapitels „Feuer“ stand das Nichtmetall Sauerstoff. Dabei haben wir unter anderem gelernt, dass unedle Metalle mit Sauerstoff zu Metalloxiden reagieren. Neben dem Sauerstoff gibt es noch andere Nichtmetalle. Einige von ihnen werden wird uns nun genauer anschauen. Die meisten dieser Nichtmetalle reagieren mit Sauerstoff zu Nichtmetalloxiden.
Die Nichtmetalle findest du rechts im Periodensystem der Elemente (mit Ausnahme von Wasserstoff). In dem unten abgebildeten Periodensystem der Elemente (PSE) sind die Nichtmetalle rot umrandet. Es gibt Elemente, die schon einige metallische Eigenschaften besitzen und daher Halbmetalle genannt werden. Es sind: Bor, Silicium, Germanium, Arsen, Selen, Antimon, Tellur, Polonium und Astat.
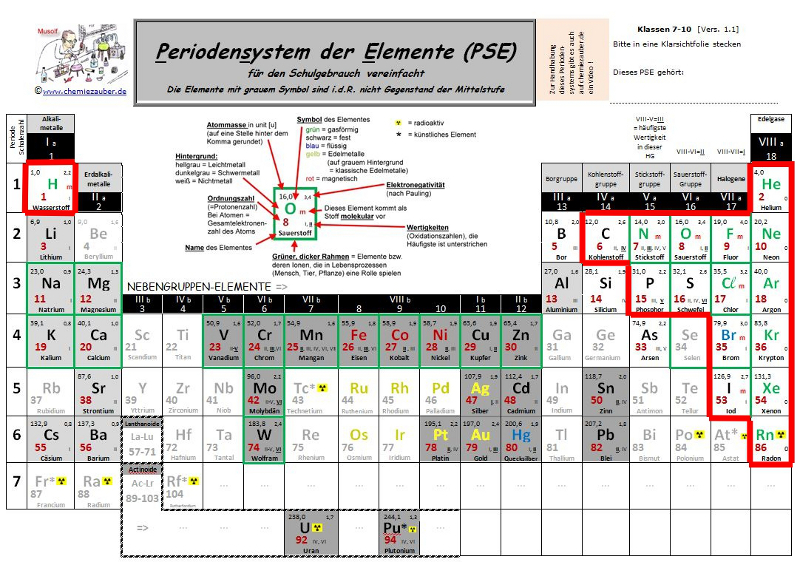
Du kennst schon folgende Nichtmetalle:
Wasserstoff, Stickstoff, Sauerstoff und die Edelgase Helium, Neon, Argon, Krypton, Xenon und Radon.
-
Stickstoff
(4)
Weitere Bestandteile der Luft

Stickstoff
Kohlenstoff -
Kohlenstoff und seine Oxide
(5)
Weitere Nichtmetalle und deren Oxide

Stickstoff Kohlenstoff und seine Oxide
Treibhauseffekt
und Klimawandel-
Treibhauseffekt und Klimawandel
(1)
Kohlenstoff und seine Oxide

Kohlenstoff und
seine OxideTreibhauseffekt und Klimawandel
Der Kreislauf des Kohlenstoffs
-
Treibhauseffekt und Klimawandel
(1)
-
Silicium - ein "Grenzgänger"
(0)
- Exkurs: Glas (2)
-
Schwefel und seine Oxide
(6)
Weitere Nichtmetalle und deren Oxide

Schwefel und seine Oxide
Glühende Lava hat eine Temperatur von ca. 1200°C.
- Luftschadstoffe (1)
-
Wasserstoff
(4)
Weitere Bestandteile der Luft

Wasserstoff
Wasserstoff kommt in der unteren Erdatmosphäre in freiem Zustand nur spurenweise vor (5·10-5 Vol.%) [1]. Siehe auch: Zusammensetzung der Atmosphäre in Volumenprozent. Im Weltall ist es das häufigste Element.[1] Lehrbuch der Anorganischen Chemie, Holleman-Wiberg, de Gruyter, 1976, S. 49
- Luftschiffe (1)
-
Stickstoff
(4)
-
Von der Wertigkeit zum Reaktionsschema
(2)

Von der Wertigkeit zum Reaktionsschema
Einführung
 Advanced Organizer
Advanced OrganizerWir haben gesehen, dass sowohl Kohlenstoff als auch Schwefel unterschiedliche Oxide bilden kann.
Mit Hilfe der Wertigkeit (oder auch Bindigkeit) kannst du das Teilchenverhältnis der kleinsten Baueinheit einer Verbindung bestimmen. Erst wenn du das beherrschst, kannst du alle chemischen Reaktionsschemata aufstellen.
Einige Elemente können verschiedene Wertigkeiten haben (insbesondere die so genannten Übergangsmetalle (siehe auch PSE).
- Stoffe (2) (3)
-
Wasser (1)
(0)
Wasser (1)

Orientierung
Einführung
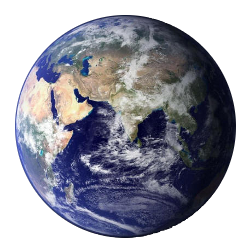 Advanced Organizer
Advanced Organizer"Alles ist aus dem Wasser entsprungen! Alles wird durch das Wasser erhalten!"
Johann Wolfgang Goethe
Wenn es den Stoff Wasser nicht gäbe und Wasser nicht bei Raumtemperatur flüssig wäre, dann gäbe es auch kein Leben.
Die komplette Unterrichtseinheit ist in drei Phasen geteilt:
PHASE 1:
Im Kapitel "Wasser (1)" geht es in erster Linie um Wissenswertes zum Thema Wasser. Hierbei sind keine chemischen Kenntnisse nötig.
Einige besondere Eigenschaften des Wasser sind aber ohne die Kenntniss vom Aufbau der Atome und des Zustandekommens von Molekülen nicht zu verstehen. Das wird beim Leidenfrost-Effekt deutlich: Warum bildet nur Wasser eine Tropfenform? Und warum sind im Wasser-Molekül immer zwei Wasserstoff-Atome mit einem Sauerstoff-Atom gebunden?
PHASE 2:
Daher werden wir uns anschließend mit dem Kapitel "Ein neues Atommodell muss her" beschäftigen.
PHASE 3:
Im Kapitel "Wasser (2)" wird dann deutlich, warum Wasser bei Raumtemperatur flüssig ist, wieso Wasser eine Oberflächenspannung besitzt, die wir in z.B. Form von Wassertropfen erleben. Wir wenden also die Erkenntnisse aus der Phase 2 an.
Arbeitsform
Die Unterrichtseinheit ist auf ein selbstständiges Lernen aufgebaut. Das verlangt einige Selbstdisziplin von Dir!

Nötige Vorkenntnisse

Nötige Vorkenntisse für die Phase 1 - Links
- Ich kann die Atomhypothese von Dalton wiedergeben.
- Ich kann das Teilchenmodell für die Interpretation der Aggregatzustände und deren Übergänge erklären.
- Ich kann die Fachbegriffe Atom, Element, Verbindung und Molekül erläutern. Mach den Test, um dich selbst zu überrüfen, ob du sicher mit diesen extem wichtigen Fachbegriffen umgehen kannst!
- Ich kann ein vollständiges Versuchsprotokoll nach den erlernten Kriterien schreiben.
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links- Über die Probleme, die im Zusammenhang mit Wasser auftreten (können), Bescheid wissen:
- Wasserknappheit in verschiedenen Ländern
- Wasserverschmutzung
- Eutrophierung ("Umkippen" eines Sees)
- Hieraus Schlussfolgerungen ziehen, um daraus auch Entscheidungen für das eigene alltägliche Handeln zu treffen.
Fachbegriffe
Fachbegriffe, Definitionen
- Wasserfußabdruck
- Virtuelles Wasser
- Taupunkt
- relative Luftfeuchtigkeit
Phänomene
Gessetzmäßigkeiten anwenden, Phänomene erklären
- Erklären können, warum ein Spiegel im Badezimmer beschlägt, wenn man heißes Wasser in die Badewanne laufen lässt.
- Erklären können, wie Wolken entstehen.
- Den Leidenfrosteffekt erklären können und daraus erkennen, dass man sehr heiße Gegenstände schlecht mit Wasser kühlen kann.
Zusammenhänge
Methodische und experimentelle Fertigkeiten
- Erstellen von Diagrammen (Kreisdiagramm, Balkendiagramm, Streifendiagramm).
- Aus einem Fließtext ein Flussdiagramm (Fließdiagramm) anfertigen.
- Aus einer Concept-Map einen Fließtext erstellen können.
- Aus dem Internet ein Bild in einen Text (Textverarbeitungsprogramm) einfügen können.
- Mit Hilfe von wasserfreiem, weißen Kupfer(II)-sulfat Wasser nachweisen können.
Beispiele für Lapbooks zum Thema "Wasser / Ein neues Atommodell muss her"
-
Ein neues Atommodell muss her!
(0)

Orientierung
Einführung

Advanced Organizer
Bisher haben wir die Vorstellungen von Demokrit und Dalton kennen gelernt. Das Teilchenmodell hat uns geholfen vor allem die physikalischen Eigenschaften von Stoffen zu deuten. Die Vorstellung von Dalton machte uns deutlich, dass bei einer chemischen Reaktion die Atome anders kombiniert werden, wobei kein Atom verloren geht oder hinzu kommt (Massenerhaltungssatz). Um aber zu verstehen, warum Atome miteinander reagieren und warum es Moleküle mit einem typischen Zahlenverhältnis der Atome gibt, müssen wir eine genaue Vorstellung vom Bau der Atome haben.
Nötige Vorkenntnisse
 Nötige Vorkenntnisse - Links
Nötige Vorkenntnisse - Links- Ich kann die Nachweisreaktion für Sauerstoff mit Fachbegriff nennen, beschreiben und sicher durchführen. Ich kann das Ergebnis mit Fachsprache formulieren.
- Ich kann die Nachweisreaktion für Wasserstoff nennen und sicher durchführen. Ich kann die Beobachtungen der positiven Nachweisreaktion nennen und aus jeder Beobachtung eine Auswertung formulieren. Ich kann das Ergebnis mit Fachsprache formulieren.
- Ich kann ein Wortreaktionsschema aufstellen.
- Ich kann die Unterschiede zwischen einer exothermen und einer endothermen Reakion im Sinne einer Energiebilanz zwischen Aktivierungsenergie und frei werdender Energie erklären und in Form einer Skizze darstellen.
- Ich kann eine Summenformel aufstellen.
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links-
Ich kann mit Hilfe von Atommodellen erläutern, wie man sich Atome aufgebaut vorstellen kann und ich kann dadurch erklären, wie sich Atome binden und warum sie es tun.
Fachbegriffe, Personen
Fachbegriffe, Definitionen, Personen
- Atombindung
- Atommasse
- Dipol
- bindendes Elektronenpaar
- Edelgaskonfiguration
- Elektrolyse
- Elektron
- Elektronegativität
- Elektronegativitätsdifferenz
- Elektronenpaarbindung
- Elementarteilchen
- gemeinsames Elektronenpaar
- Hauptgruppe
- Hypothese
- Isotop
- Lernbausteine
- Knallgasreaktion
- kovalente Bindung
- Kugelschalenmodell
- Leidenfrost-Effekt
- Lewisformel
- Neutron
- nicht bindende Elektronenpaar
- Oktettregel
- Ordnungszahl
- Partialladung
- Periode
- Proton
- Schalenmodell
- Summenformel
- Teilladung
- Unit
- Valenzelektron
- Valenzstrichformel
- vereinfachtes Schalenmodell
- Wasserfußabdruck
- Rutherford
- Niels Bohr
- Lord Rutherford
- Niels Bohr
- Streuversuch
- Erweitertes Kern-Hülle-Modell = Schalenmodell
- Kugelschalenmodell
- [Kugelwolkenmodell (KWM)]
- Atomkern
- Atomhülle
- Proton
- Elektron
- Neutron
- Atommasseneinheit: unit [u]
- Masse und Ladungen der Elementarteilchen
- Isotope
- Valenzschale, Valenzelektronen
- Edelgaskonfiguration
- Periodensystem der Elemente (PSE) - Prinzipieller Aufbau
- Atombindung (kovalente Bindung)
- Valenzstrichformelschreibweise
- Elektronegativität, Elektronegativitätsdifferenz
- polare Atombindung
- Partialladungen
- Dipolmomente
Anknüpfungen
 Anknüpfungen - Links
Anknüpfungen - Links- Aufgrund der hohen Elektronegativitätsdifferenz (> 0,5) zwischen einem Sauerstoff- und einem Wasserstoff-Atom findet eine Ladungsverschiebung der Bindungselektronen im Wasser-Molekül statt. Dies führt dazu, dass polare Atombindungen im Wasser-Molekül entstehen bzw. positive Partialladungen an den Wasserstoff-Atomen und eine negative Partialladung am Sauerstoff-Atom. Ein Wasser-Molekül ist also ein Dipol-Molekül.
- Als Dipolmolekül können die Wasser-Moleküle untereinander sogenannte "Wasserstoffbrücken" ausbilden. Das sind Anziehungskräfte, die in etwa so stark sind , wie ein Zwanzigstell einer Atombindung. "Wasserstoffbrücken" sind ein Spezialfall von Dipol-Dipol-Wechselwirkungen. Sie sind auch die bekanntesten Dipol-Dipol-Wechselwirkungen.
- Aufgrund dieser Anziehungskräfte entsteht die Oberflächenspannung des Wassers. Außerdem ist diese Anziehungskraft dafür verantwortlich, dass die Wasser-Moleküle - trotz ihrer vergleichsweise geringen Molekülmasse - erst bei 100 °C so viel Energie besitzen, dass sie in den gasförmigen Aggregatzustand übergehen können. Ohne "Wasserstoffbrücken" wäre Wasser nur im Temperaturbereich zwischen -90 und -80 °C flüssig.
- Wasser - eine Verbindung (1)
- Modelle (3)
- Das Schalenmodell (3)
- Das Kugelwolkenmodell (1)
- Atome bilden Moleküle (6)
- Elektronegativität (2)
-
Wasser (2)
(0)
Wasser (2)

Orientierung
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links-
...
Anknüpfungen
 Anknüpfungen - Links
Anknüpfungen - LinksDie Löslichkeit eines Stoffes in Wasser richtet sich danach, inwiefern der zu lösende Stoff polare Eigenschaften besitzt, um sich zwischen die Wassser-Moleküle zu "schummeln". Das wird in der folgenden Unterrichtseinheit "Salze" auch zum Thema werden.
- Die Ausbildung von Dipol-Dipol-Wechselwirkungen zwischen Molekülen - oder auch innerhalb eines Moleküls - ist von besonderer Bedeutung, um die typischen Eigenschaften der organischen Stoffgruppen, die in der 10. Klasse unterrichtet werden, zu begreifen.
- Wasserstoffbrücken (1)
- Wasseranomalien (2)
- Wasser, ein Lösemittel (1)
-
-
Das Labor
(0)
-
Ionenverbindungen (1)
(0)

Basic 2
Während in Basic 1 - gerade gegen Ende - die Struktur von Stoffen, die durch AtombindungenLex (kovalente Bindungen, Elektronenpaarbindungen) geprägt sind, herausgearbeitet wurde, werden in Basic 2 (und auch in Basic 3) Stoffgruppen behandelt, deren Teilchen nicht durch gemeinsame Benutzung von Elektronen sich zusammen fügen, sondern durch die Anziehung von entgegengesetzt geladenen Teilchen (IonenLex). Es geht also um sogenannte Ionenverbindungen!
-
Salze (1)
(0)

Orientierung
Einführung

Advanced Organizer
Salze sind VerbindungenLex, die aus geladenen Teilchen aufgebaut sind. Der wichtigste Vertreter dieser Stoffklasse ist Natriumchlorid (Speisesalz, Tausalz, Pökelsalz). Weil die Teilchen unterschiedlich geladen sind, "kleben" sie fest aneinander. So erklären sich die typischen Eigenschaften von Salzkristallen. Sie sind z.B. spröde und schwer schmelzbar.
Nötige Vorkenntnisse

Nötige Vorkenntisse - Links
-
Atombau nach dem Schalenmodell (erweitertes Kern-Hülle-Modell) oder nach dem Kugelwolkenmodel
- Grundbegriffe: ElementLex, VerbindungLex, MolekülLex
- Edelgaskonfiguration.
- Elektronegativität, Elektronegativitätsdifferenz.
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links- Erkennen, dass Atome nicht nur durch gemeinsame Benutzung von Elektronen die Edelgaskonfiguration erhalten können, sondern unter bestimmten Bedingungen (z.B. Elektronegativitätsdifferenz >2) auch durch Abgabe bzw. Aufnahme von Elektronen. Hierbei entstehen aus Atomen Ionen.
- Den Zusammenhang zwischen der Struktur (Bau) eines Salzes und dessen Eigenschaften erkennen und erläutern können.
- Reaktionsschemata zur Salzbildungsart "unedles Metall reagiert mit einem Halogen zu einem Salz (Halogenid)" aufstellen können.
- Aussagen über die Gewinnung, Eigenschaften, Entstehung/Vorkommen, Verwendung/Bedeutung und Namen von Natriumchlorid treffen können Aussagen über die Gewinnung, Eigenschaften, Entstehung/Vorkommen, Verwendung/Bedeutung und Namen von Natriumchlorid treffen können.
- Aussagen über die Eigenschaften von Natrium und anderen Alkalimetallen treffen können.
- Aussagen über die Eigenschaften und Bedeutung von Chlor und anderen Halogenen treffen können.
- Die Bedeutung von wichtigen Halogeniden nennen können:
- Fluoride
- Bromide
- Iodide
- Den Atomaufbau der Elemente aus der I. und VII. Hauptgruppe erläutern können.
- Den Zusammenhang zwischen der Struktur (Aufbau) eines Salzes und dessen Eigenschaften erkennen und erläutern können.
- Den hohen Schmelzpunkt erklären können.
- Die Sprödigkeit von Salzen erläutern können.
- Den kristallinen Charakter von Salzen erklären können.
- Die Löslichkeit von Salzen in Wasser erläutern können.
- Die Hygroskopizität einiger Salze erklären können.
- Die Salzbildungsart "unedles Metall reagiert mit einem Halogen zu einem Salz (Halogenid)" [1. Salzbildungsart] in Form von Wortschemata und Schemata in Symbolformelschreibweise sowie Ionenformelschreibweise für verschiedene Halogenide formulieren können.
- Die Flammenprobe als Nachweis von Kationen kennen, beschreiben und durchführen können. Das Aussenden (emittieren) von Licht bestimmter Wellenlänge mit Hilfe des Schalenmodells erklären können.
- Die Silbernitratprobe als Nachweis für die Anionen der Halogenide durchführen und beschreiben können und mit Hilfe eines Reaktionsschemas in Ionenformelschreibweise erklären können.
Stoffe
Stoffe, Bedeutung für Mensch, Pflanze, Tier, Umwelt
Eigenschaften / Struktur
Eigenschaften / Struktur
Phänomene / Zusammenhänge
Gesetzmäßigkeiten anwenden, Phänomene deuten, Reaktionsschemata aufstellen (Verhältnisformeln, Ionenformelschreibweise), Nachweismethoden experimentell durchführen
Zusammenfassung

Zusammenfassung - Salze (1)
Das bekannteste und bedeutendste Salz ist "Speisesalz" (chemischer Name: Natriumchlorid). Den Namen "Kochsalz" sollte man nicht verwenden. Zum Kochen braucht man Wasser, kein Salz. Natriumchlorid wird hauptsächlich zum Würzen von Speisen benutzt. Je nachdem für welchen Zweck es benutzt wird, erhält es einen anderen Namen:
- Tausalz, weil es den Gefrierpunkt von Wasser herabsetzen kann.
- Pökelsalz, weil es konservierende Wirkung hat.
- Speisesalz, weil wir Speisen damit würzen, um die lebensnotwendigen Mineralien Natrium-Ionen und Chlorid-Ionen zu erhalten.
- Früher war Natriumchlorid sogar so wertvoll, dass man es als Zahlungsmittel benutzt hat.
Natriumchlorid ist eine Verbindung aus den ElementenLex Natrium und Chlor. Genauer gesagt: Es ist eine Verbindung aus Natrium-Ionen und Chlorid-Ionen. Im Labor kann man es aus den Elementen Natrium und Chlor synthetisieren. Dabei geben die Natrium-Atome jeweils ein Elektron an jeweils ein Chlor-Atom ab. Dadurch erhalten beide Elemente eine Edelgaskonfiguration. Allerdings sind diese Teilchen nun geladen und werden Ionen genannt. Positiv geladene Ionen heißen mit allgemeinem Namen Kationen, negativ geladene Ionen nennt man Anionen. Salze bestehen immer aus Kationen und Anionen!
Metalle (Metall-Atome) und Metall-Ionen kann man mit Hilfe der Flammenprobe nachweisen. Die Anionen, die aus den Elementen der VII. Haupfgruppe des PSE gebildet werden können, kann man mit der Silbernitratprobe nachweisen.
Die Bindung (Anziehungskraft) zwischen den ungleichnamig geladenen Ionen nennt man Ionenbindung. Kationen und Anionen bilden ein Ionengitter (Ionenverband). Die Ionenbindung ist eine stärkere Bindung als die Atombindung. Das erklärt auch die typischen Eigenschaften von Salzen: Die kristalline Struktur, die Sprödigkeit, die oft vorhandene Wasserlöslichkeit und die hohen Schmelzpunkte.
Salze, deren Anionen sich aus den Elementen der VII. Hauptgruppe des PSE herleiten lassen, nennt man mit allgemeinem Namen Halogenide.
- Salze, speziell Kochsalz (2)
- Chlor und Natrium (3)
-
Natriumchloridsynthese
(4)
Salze (1)

Natriumchlorid-
synthese - Eigenschaften von Salzen (4)
- Halogene / Halogenide (2)
- Reaktionsschema in Ionenformelschreibweise (2)
- Nachweis für Kationen - Flammenprobe (1)
- Nachweis der Halogenid-Ionen: Die Silbernitratprobe (1)
- Zusammenfassung und Übungen (1)
-
- Metalle / Metallbindung (0)
-
Reduktion / Redoxreaktionen
(0)

Orientierung
Reduktion eines Metalloxides -
Reduktion eines Metalloxides
(4)
Reduktion / Redoxreaktion

Orientierung Reduktion eines Metalloxides
 Oxidation bedeutet Reaktion mit Sauerstoff 1,
Oxidation bedeutet Reaktion mit Sauerstoff 1,
Reduktion bedeutet Entzug von Sauerstoff aus einem Oxid.1 Genauer muss es heißen: Die Reaktion mit Sauerstoff ist eine Art der Oxidation.
 Doch welche Stoffe können den Oxiden den Sauerstoff entreißen?
Doch welche Stoffe können den Oxiden den Sauerstoff entreißen?Wir wollen uns das einmal bei der Verbindung Kupfer(II)-oxid näher anschauen und dieses Oxid mit Eisen reagieren lassen.
Eisen ist schließlich wesentlich unedler als Kupfer. Unedle Metalle reagieren heftiger mit Sauerstoff als edlere Metalle. Möglicherweise kann daher Eisen dem Kupferoxid den Sauerstoff entreißen. Eisen hat eine größere Affinität zu Sauerstoff als Kupfer.
-
Eisen und Stahl
(0)
-
Gewinnung von Eisen
(1)
Eisen und Stahl

Eisen und Stahl Gewinnung von Eisen
-
Aluminothermisches Verfahren
(1)
Eisen und Stahl

Gewinnung von Eisen Aluminothermisches Verfahren
-
Hochofen
(1)
Eisen und Stahl

Aluminothermisches Verfahren Der Hochofen
-
Gewinnung von Eisen
(1)
-
Reduktion eines Metalloxides
(4)
-
Salze (1)
(0)
-
Ionenverbindungen (2)
(0)

Basic 3
Im letzten Unterrichtsblock hast du gelernt, dass Salze aus Ionen bestehen. Auch Oxide sind salzähnliche Verbindungen, da sie ebenfalls aus Ionen bestehen. Beide Stoffklassen kann der Chemiker herstellen:
Salze:
unedles Metall + Halogen → Metallhalogenid / exotherm
Oxide:
unedles Metall + Sauerstoff → Metalloxid / exotherm
In diesem Unterrichtsblock lernst du zwei weitere Stoffklassen kennen, die zu den Ionenverbindungen zählen: Säuren und Laugen.
Darüber hinaus lernst du weitere Möglichkeiten kennen, wie man Salze herstellen kann.
-
Säuren
(0)
Säuren

Orientierung
Einführung

Advanced Organizer
Säuren spielen im Alltag und in der Industrie eine außerordentlich wichtige Rolle in vielen Bereichen auf die in diesem Kapitel näher eingegangen wird. Da Säuren ätzend sein können, also z.B. die Haut, Augen oder Kleidung zerstören können, sind besondere Schutzmaßnahmen beim Experimentieren nötig. Außerdem ist es sehr hilfreich ein Mittel zu haben, um Säuren von anderen ungefährlichen Stoffen unterscheiden zu können. Es gibt aber noch andere typische Eigenschaften von Säuren, die hier näher untersucht werden.
Kern dieses Kapitels ist die Beschreibung eines Teilchens, das für alle gemeinsamen Eigenschaften der Säuren verantwortlich ist.
Das darauf folgende Kapitel "Saurer Regen" ist die Überleitung zu einem Kapitel, indem die Bedeutung von Säuren exemplarisch an der Kohlensäure veranschaulicht wird.
Nötige Vorkenntnisse

Nötige Vorkenntisse - Links
- Ich kann Ionen von Atomen aufgrund ihrer Struktur unterscheiden.
- Ich kann das Zustandekommen einer polaren Atombindung erklären.
- Ich kann die elektrische Leitfähigkeit von wässrigen Salzlösungen erläutern.
- [Elektrolyse]
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links- Ich habe Kenntnisse über die Eigenschaften von Säuren, kann sie identifizieren, kenne deren Verwendungsmöglichkeiten bzw. Bedeutung (und Vorkommen).
- Ich kann entsprechend der Vorschriften sicher mit Säuren experimentieren. So z.B. Säuren mit unedlen Metallen reagieren lassen.
- Ich kenne die Säurerest-Ionen der wichtigsten Säuren und weiß, welches Ion für alle gemeinsamen Säureeigenschaften verantwortlich ist.
Stoffe
Eigenschaften, Struktur, Summenformel, Bedeutung für Mensch, Pflanze, Tier, Umwelt
- Ich kann alle gemeinsamen Eigenschaften von Säuren bzw. sauren Lösungen nennen und erklären.
- Ich kann Säuren nennen, die Tiere und Pflanzen zum Schutz verwenden.
- Ich kann Säuren aus unserem Alltag nennen und deren Verwendung beschreiben.
- Ich kann die Farbreaktion vom Universalindikator für Säuren, Laugen und Wasser nennen und entsprechend Stoffe identifizieren.
Phänomene
Gesetzmäßigkeiten anwenden, Phänomene deuten, Reaktionsschemata aufstellen (Summenformeln, Ionenformelschreibweise, Strukturformeln)
- Ich kann auf der Grundlage der Säuretheorie von Arrhenius die Dissoziationsgleichungen für verschiedene Säuren aufstellen.
- Ich kann für den Reaktionstyp "Säure reagiert mit einem unedlen Metall" bei Vorgabe einer Säure und eines Metalls das Reaktionsschema in Summenformelschreibweise und Ionenformelschreibweise formulieren.
Zusammenhänge
Vorgänge, Zusammenhänge, Funktionsweisen (im Zusammenhang mit der Bedeutung für Mensch, Tier, Pflanze und Umwelt) erläutern und bewerten
- Ich kann die Bedeutung bzw. Funktion der Magensäure erklären.
- Ich kann erklären, wie der Gerichtsmediziner den Zeitpunkt des Todes ermitteln kann.
- Ich kann die Bedeutung bzw. Funktion des Säureschutzmantels der Haut beschreiben und den Begriff "pH-neutrale Seife" bewerten.
Weitere Fertigkeiten
Handwerkliches, ...
- Ich kenne die besonderen Vorsichtsmaßnahmen beim Umgang mit Säuren und kann sie beim Experimentieren anwenden.
- Ich kann mit Hilfe des Universalindikators Stoffe als Säuren, Laugen oder Wasser identifizieren.
- Ich kann ein Experiment durchführen, bei dem eine Säure mit einem unedlen Metall reagiert, und ich kann das entstehende Gas nachweisen.
Zusammenfassung
Basics

- Säuren sind sauer schmeckend (z.B. Citronensäure oder Ascorbinsäure), oder sie sind ätzend und können unedle Metalle und organische Stoffe zerstören.
- Die ätzenden Säuren werden vor allem in der Technik verwendet.
- Wässrige Lösungen von Säuren enthalten Wasserstoff-Ionen (Protonen). Dies sind die eigentlichen "Säureteilchen". Deren Konzentration bestimmt unter anderem, ob die Säure nur sauer schmeckt oder ätzend ist.
- Säuren färben den Universalindikator - je nach dem pH-Wert der Säure - orange (pH-Wert knapp unter 7) bis tiefrot (pH-Wert um 1).
- Unabhängig von der Konzentration der Wasserstoff-Ionen gibt es starke Säuren (Salzsäure, Schwefelsäure) und schwache Säuren (Essigsäure, Kohlensäure). Das hängt vom Dissoziationsgrad der Säure ab.
- Bei der Reaktion einer Säure mit einem unedlen Metall entsteht Wasserstoff und ein Salz. Die Reaktion ist exotherm.
-
Anzeigen von Säuren und Laugen
(1)
Säuren

Anzeigen von Säuren und Laugen
- Eigenschaften von Säuren (1)
- Säuren im und am Menschen (1)
- Säuren im Umfeld (1)
- Chlorwasserstoff und Salzsäure (1)
- Arrhenius (3)
-
Säuretheorie von Brønsted
(1)
- Konzentration und Stärke einer Säure (2)
- Säuren reagieren mit unedlen Metallen (2)
- Test zum Thema Säuren (1)
-
Der Saure Regen
(0)
Der Saure Regen

Orientierung
Einführung
© tossi66 - Fotolia.com
Advanced Organizer
Das Regenwasser besaß in den 70er Jahren in einigen Gebieten einen pH-Wert von bis zu unter 3! Das entspricht dem pH-Wert von Haushaltsessig. Das führte zu einem dramatischen Absterben von Bäumen in bestimmten Gebieten wie z.B. im Schwarzwald.
Nicht nur Bäume und Pflanzen leiden unter einem zu niedrigen pH-Wert. Ist der Boden zu sauer, so hat das auch erheblichen Einfluss auf Tiere, die in diesem Lebensraum leben. Die Übersäuerung von Gewässern führt zum Rückgang des Fischbestandes. Der Saure Regen greift aber auch Kalk- und Sandstein an.
Die Situation hat sich heute weitestgehend normalisiert. Als "sauer" wird heute Regenwasser mit einem pH-Wert von unter 5,6 bezeichnet.
Dieses Kapitel hinterleuchtet die chemischen Zusammenhänge, die für den Sauren Regen verantwortlich waren. Hierbei werden Vorkenntnisse aufgefrischt.
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links- Ich kann über die chemischen Hintergründe des Sauren Regens in Fachsprache berichten und entsprechende Reaktionsschemata formulieren.
- Ich kann die Folgen des Sauren Regens auf die Flora, Fauna und auf Kalkstein nennen.
- Ich weiß, wie die Situation in Deutschland heute ist.
Stoffe
Eigenschaften, Struktur, Summenformel, Bedeutung für Mensch, Pflanze, Tier, Umwelt
- Ich kann die Summenformel und die Eigenschaften von Schwefeldioxid nennen.
- Ich kann die Summenformel und die Eigenschaften von Schwefeltrioxid nennen.
Phänomene
Gesetzmäßigkeiten anwenden, Phänomene deuten, Reaktionsschemata aufstellen (Summenformeln, Ionenformelschreibweise, Strukturformeln)
Zusammenhänge
Vorgänge, Zusammenhänge, Funktionsweisen (im Zusammenhang mit der Bedeutung für Mensch, Tier, Pflanze und Umwelt) erläutern und bewerten
- Ich kann die Folgen des Sauren Regens nennen.
- Ich kann erklären, warum sich die Situation in Deutschland normalisiert hat.
Zusammenfassung
Basics

- Früher war die Kohle sehr schwefelhaltig. Daher entstanden bei der Verbrennung von Kohle auch Schwefeloxide.
- Schwefeldioxid ist ein farbloses, stechend riechendes, giftiges, umweltschädliches Gas, das mit Regenwasser zu Schwefliger Säure (H2SO3) reagiert.
- Schwefeltrioxid ist ein weißer Feststoff (in der Luft bei der Entstehung als weißer Rauch sichtbar), der mit Regenwasser zu Schwefelsäure (H2SO4) reagiert.
- Auch andere Nichtmetalloxide (Stickstoffoxide) reagieren mit Wasser zu Säuren. All diese Säuren führten in den 70er Jahren zu einem pH-Wert des Regenwassers, der weit unter 5,6 lag.
- In Deutschland wird die Kohle mittlerweile entschwefelt (Rauchgasentschwefelung).
Anknüpfungen
 Anknüpfungen - Links
Anknüpfungen - Links- Das Nichtmetalloxid Kohlenstoffdioxid reagiert mit Wasser zur Kohlensäure.
-
Rund um die Kohlensäure
(0)
Rund um die Kohlensäure

Orientierung
Einführung

Advanced Organizer
Viele glauben, die aufsteigenden Blasen bei einem kohlensäurehaltigen Getränk wären die Kohlensäure. Dem ist aber nicht so. Das Gas, was ausperlt und für das Zischen beim Öffnen einer Flasche verantwortlich ist, ist Kohlenstoffdioxid. Ein extremes Beispiel werden wir beim Cola-Mentos-Experiment sehen.
Kohlenstoffdioxid spielt bei der Diskussion um den Klimawandel eine große Rolle. Auch darüber wird es in diesem Kapitel gehen.
 Die Kohlensäure selbst existiert nur für einige Nanosekunden. Die Säurereste jedoch spielen beim natürlichen Kalkkreislauf, also bei der Bildung von Gebirgen, Tropfsteinhöhlen oder Muschelschalen, eine außergewöhnliche Rolle. In diesem Zusammenhang wird auch geklärt, was "hartes" Wasser ist und welche Folgen es für unseren Alltag bedeuten kann.
Die Kohlensäure selbst existiert nur für einige Nanosekunden. Die Säurereste jedoch spielen beim natürlichen Kalkkreislauf, also bei der Bildung von Gebirgen, Tropfsteinhöhlen oder Muschelschalen, eine außergewöhnliche Rolle. In diesem Zusammenhang wird auch geklärt, was "hartes" Wasser ist und welche Folgen es für unseren Alltag bedeuten kann.Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links- Ich kann die Bedeutung und den chemischen Unterschied zwischen hartem und weichem Wasser an Alltagsbeispielen erläutern und weiß, wie man Kalkränder entfernt.
- Ich kann Eigenschaften und Verwendungsmöglichkeiten von Soda und Natron nennen.
Stoffe
Eigenschaften, Struktur, Formel, Bedeutung für Mensch, Pflanze, Tier, Umwelt
- Ich kann Stoffe nennen, die hauptsächlich aus Calciumcarbonat bestehen.
- Ich kann die Summenformel (und die Strukturformel) der Kohlensäure zeichnen.
- Ich kann die Verhältnisformel von Soda aufstellen, den systematischen Namen nennen und die Eigenschaften und Verwendungsmöglichkeiten dieses Salzes der Kohlensäure nennen.
- Ich kann die Verhältnisformel von Natron aufstellen, den systematischen Namen nennen und die Eigenschaften und Verwendungsmöglichkeiten dieses Salzes der Kohlensäure nennen.
Phänomene
Gesetzmäßigkeiten anwenden, Phänomene deuten, Reaktionsschemata aufstellen (Summenformeln, Ionenformelschreibweise, Strukturformeln)
- Ich kann für den Lösevorgang von Kohlenstoffdioxid in Wasser ein Schema unter Verwendung eines Gleichgewichtspfeiles aufstellen.
- Ich kann die vollständige Dissoziationsgleichung der Kohlensäure detailliert formulieren.
- Ich kann erklären, wieso eine vorher geschüttelte Flasche mit einem kohlensäurehaltigen Getränk beim Öffnen sprudelt.
- Ich kann erklären, wieso sich beim Erhitzen eines kohlensäurehaltigen Getränks der pH-Wert erhöht.
Zusammenhänge
Vorgänge, Zusammenhänge, Funktionsweisen (im Zusammenhang mit der Bedeutung für Mensch, Tier, Pflanze und Umwelt) erläutern und bewerten
- Ich kann die chemischen Zusammenhänge des natürlichen Kalkkreislaufes erläutern (auch mit Hilfe von Reaktionsschemata) und die Bedeutung für unseren Planeten, unsere Umwelt und für Korallen und Schalentiere der Meere beschreiben.
- Ich kann die chemischen Hintergründe für den Nachweis von Calciumcarbonat anhand eines Reaktionsschemas erläutern.
- Ich kann unter Verwendung eines Reaktionsschemas erläutern, wie man mit Hilfe von Essig Kalkränder entfernt.
Zusammenfassung
Basics

- Die Dissoziation der Kohlensäure erfolgt in zwei Schritten. Zunächst bildet sich der Säurerest Hydrogencarbonat-Ion, dann der Säurerest Carbonat-Ion.
- Kohlensäurehaltiges Wasser reagiert mit Calciumcarbonat.
- Folgende Stoffe bestehen aus Calciumcarbonat oder besitzen einen sehr hohen Gehalt an Calciumcarbonat: Kalk, Kesselstein, Muschelschalen, Korallen, Marmor, Kreide.
- Kern des natürlichen Kalkkreislaufes ist das Wechselspiel zwischen wasserunlöslichem Calciumcarbonat und wasserlöslichem Calciumhydrogencarbonat. Bei den Prozessen spielt Kohlenstoffdioxid eine bedeutende Rolle.
- Hartes Wasser enthält eine hohe Konzentration an Calcium- und Magnesium-Ionen und Härtebildnern. Temporäre Härtebildner sind die Hydrogencarbonat-Ionen, die mit den Calcium- und Magnesium-Ionen schwer lösliche Salze bilden. Permanente Härtebildner sind Salze mit Säurerest-Ionen, die mit Calcium- und Magnesium-Ionen keine schwer löslichen Salze bilden.
- Hartes Wasser setzt die Reinigungskraft von Seifen herab, macht beim Wäschewaschen die Wäsche hart und bildet beim Erhitzen und Verdunsten Kesselstein (Kalkränder).
- Im Haushalt kann man Kesselstein, also Kalkablagerungen, mit Essig entfernen.
Anknüpfungen
 Anknüpfungen - Links
Anknüpfungen - Links- Alkalische Reaktion von Soda und Natron => Laugen.
- Oberstufe: Verschiebung von dynamischen Gleichgewichten (z.B. Haber-Bosch-Verfahren)
- Die Kohlensäure (2)
- Dissoziation der Kohlensäure (1)
-
Calciumcarbonat
(1)
Rund um die Kohlensäure

Calciumcarbonat
Bildung von Calciumhydrogencarbonat, der natürliche Kalkkreislauft
- Kohlensäurehaltiges Wasser reagiert mit Calciumcarbonat (2)
- Hartes Wasser - weiches Wasser (2)
-
Laugen / Basen
(0)
Laugen / Basen

Orientierung
Einführung
Advanced Organizer
Die negativ geladenen Hydroxid-Ionen sind ähnlich aggressiv wie die positiv geladenen Wasserstoff-Ionen, den eigentlichen "Säureteilchen". Befinden sich Hydroxid-Ionen im Wasser, dann spricht man auch von einer Lauge. Säuren und Laugen werden oft in einem Zusammenhang genannt. Es sind "Gegenspieler", wie wir besonders im nächsten Kapitel (Salze (2) - Salzbildungsarten) bei der Neutralisationsreaktion sehen werden.
In diesem Kapitel werden wir wichtige Laugen kennenlernen, die auch in unserem Alltag eine Rolle spielen.
Wir werden sehen, dass es verschiedene Möglichkeiten gibt, Laugen herzustellen. So bilden Soda und Natron (zwei Salze der Kohlensäure) Laugen, einige Metallhydroxide sind dazu auch in der Lage und die Alkalimetalle reagieren in Wasser außerordentlich heftig zu Laugen.
Bei der strukturellen Beschäftigung mit den Laugen, werden wir uns noch einmal die Theorien von Arrhenius und Brönsted anschauen. Dabei werden wir die grundlegenden Unterschiede herausarbeiten.
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - LinksStoffe
Eigenschaften, Struktur, Formel, Bedeutung für Mensch, Pflanze, Tier, Umwelt
- Die Hydroxid-Ionen in Strukturformelschreibweise und Summenformelschreibweise (Ionenformel) schreiben können.
- Beispiele für die Bedeutung von Natriumlauge bzw. Natriumhydroxid im Alltag nennen können.
- Calciumlauge und Bariumlauge als Nachweismittel für Kohlenstoffdioxid kennen.
- Eigenschaften von Laugen nennen können.
- Eigenschaften und Verwendungsmöglichkeiten von Natron (Natriumhydrogencarbonat) nennen können.
- Eigenschaften und Verwendungsmöglichkeiten von Soda (Natriumcarbonat) nennen können.
Zusammenfassung
Basics

- Laugen sind die wässrigen Lösungen von Metallhydroxiden, deren Metall-Ionen sich aus den Metallen der I. und II. Hauptgruppe des PSE ableiten. Diese Lösungen werden auch alkalische Lösungen genannt.
- Die für alle typischen Laugeneigenschaften verantwortlichen Teilchen sind die Hydroxid-Ionen. Diese bestehen aus einem Wasserstoff-Atom und einem Sauerstoff-Atom, wobei das Sauerstoff-Atome eine ganze negative Ladung trägt, da es ein Elektron zu viel besitzt.
- Laugen fühlen sich schmierig an und haben stark ätzende Wirkung. Man sagt auch: Sie reagieren alkalisch. Sie färben den Universalindikator blau.
- Nach der Theorie von Brönsted sind Basen Stoffe, die Protonen (Wasserstoff-Ionen) aufnehmen können. Basen sind also Protonenakzeptoren.
- Die wichtigste Lauge ist Natronlauge, also die wässrige Lösung von Natriumhydroxid. Natriumhydroxid wird in einigen WC-Reinigern verwendet, eine 4%-ige Natronlauge wird als Brezellauge verwendet.
- Calciumlauge (Trivialname: Kalkwasser) und Bariumlauge (Trivialname: Barytwasser) sind Nachweisemittel für Kohlenstoffdioxid. Bei einem positiven Nachweis erfolgt eine Trübung der Lösung.
- Laugen können Säuren neutralisieren: Wasserstoff-Ionen bilden mit Hydroxid-Ionen neutrales Wasser.
- Wichtige Salze, die mit Wasser alkalisch reagieren sind Natron (Natriumhydrogencarbonat) und Soda (Natriumcarbonat).
-
Salze (2) - Salzbildungsarten
(1)
Salze (2) - Salzbildungsarten

Orientierung
Einführung

Advanced Organizer
Du hast mittlerweile erkannt, dass der Name Salz sich nicht nur auf den bekanntesten Vertreter dieser Stoffgruppe bezieht (Speisesalz), sondern sehr viele interessante Stoffe unseres Alltags einbezieht:
- Fluoride - vorbeugend gegen Karies
- Iodide - Gewährleistung der Schilddrüsenfunktion
- Calciumcarbonat (Marmor, Kreide, Muschelschalen, Kalk), ein wasserunlösliches Salz!
- Natron (Natriumhydrogencarbonat), ein Salz, das nicht nur im Backpulver Verwendung findet.
- Soda (Natriumcarbonat), welches ebenfalls vielfältige Verwendung findet - unter anderem für die Herstellung von Kernseife.
Dieses Kapitel soll dir vor Augen halten, mit welchen unterschiedlichen grundsätzlichen Möglichkeiten man Salze synthetisieren kann. Gleichzeitig dient dieses Kapitel dazu, die bisherigen Salzbildungsarten noch einmal zu wiederholen. Außerdem lernst du noch weitere Salze mit unterschiedlichsten Verwendungsmöglichkeiten kennen.
Nötige Vorkenntnisse

Nötige Vorkenntisse - Links
- Ich kann für die Salzbildung aus den Elementen die entsprechenden Reaktionsschemata aufstellen.
- Ich kann die Unterschiede, die sich in folgenden Symbolformelschreibweisen ausdrücken, beschreiben: H, H+, H2, H2O, OH-
- Ich kann die Formeln und Namen von den wichtigen Säuren und Säureresten nennen bzw. schreiben.
- Ich kann für die Säuren die entsprechenden Dissoziationsgleichungen nach Arrhenius aufstellen.
- Ich kann Reaktionsschemata in Ionenformelschreibweise ausgleichen.
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links- Ich habe ein Konzept, mit dem ich (auf z.T. unterschiedliche Arten) ein gewünschtes Salz herstellen kann.
Stoffe
Eigenschaften, Struktur, Summenformel, Bedeutung für Mensch und Pflanzen
Beispiele:
- Eisenoxid-haltiges Gestein erkennt man an der Farbe
- Silberchlorid ist ein wasserunlösliches Salz und spielt bei der Analyse von Halogeniden eine wichtige Rolle (Silbernitratprobe).
- Bariumchlorid, ein giftiges Salz, färbt die Flamme grün und wird daher in der Pyrotechnik verwendet. Die rote Armee benutzte während des zweiten Weltkrieges grünlich leuchtende Bariumchlroid-Leuchtspurgeschosse, während die Wehrmacht gelblich leuchtende Phosphor-Geschosse verwendete.
- Bariumsulfat ist wasserunlöslich und wird in der Medizin als Röntgenkontrastmittel verwendet.
- Calciumchlorid ist hygroskopisch und findet daher als Trocknungsmittel im Labor Verwendung. Zudem wird es als Geschmacksverstärker benutzt.
- Calciumnitrat wird als Düngemittel verwendet.
- Calciumsulfat ist nur schwer in Wasser löslich. Das Dihydrat wird Gips genannt.
- Kaliumchlorid findet als Geschmacksverstärker, Dünger und Streusalz Verwendung. In hoher Konzentration führt es zum Herzstillstand und wird daher der Giftspritze bei Hinrichtungen beigemischt.
- Kaliumnitrat (Kalisalpeter) ist ein wichtiger Bestandteil von Schwarzpulver. Es wird aber auch als Konservierungsstoff beim Pöckeln und als Düngemittel benutzt.
- Natriumsulfat (Glaubersalz) dient in der Medizin als Abführmittel.
- Kaliumphosphat wird Waschmitteln zugesetzt, da es die Wasserhärte herabsetzt. Da es in Gewässern jedoch ein größeres Nährstoffangebot liefert, folgt daraus ein verstärktes Algenwachstum, das zum Umkippen eines Gewässers führen kann.
Phänomene
Gesetzmäßigkeiten anwenden, Phänomene deuten, Reaktionsschemata aufstellen (Summenformeln, Ionenformelschreibweise)
- Ich kann für folgende chemische Reaktionen die Reaktionsschemata (in detaillierter Ionenformelschreibweise) aufstellen ...
- Neutralisationsreaktion
- Reaktion von Metalloxiden mit Säuren ("verkürzte" Neutralisation)
- Reaktion zwei verschiedener Salzlösungen
- Die stärkere Säure setzt die schwächere Säure aus ihren Salzen frei
- Unedle Metalle reagieren mit Säuren
Zusammenfassung
Basics

- Salze bestehen aus Ionenverbänden. Diese bestehen aus positiv geladenen, unedlen Metall-Ionen (Kationen) und negativ geladenen Säurerest-Ionen.
- Salze können aus unedlen Metallen und den Elementen der VII. Hauptgruppe (Halogene) gebildet werden. Die so gebildeten Salze nennt man mit allgemeinem Namen Halogenide.
- Auch die Metalloxide bestehen aus Ionen. Metalloxide sind salzähnliche Verbindungen.
- In wässriger Lösung können sich auch Ionen so kombinieren, dass ein schwerlösliches Salz ausfällt. Der Halogenid-Nachweis mit der Silbernitratprobe beruht auf dieses Phänomen.
- Salze können durch die Neutralisationsreaktion von Säuren und Laugen hergestellt werden. Hierbei entsteht neben dem entsprechenden Salz auch Wasser.
- Einige Metalloxide reagieren mit Säuren zu den entsprechenden Salzen, wobei auch Wasser entsteht.
- Die Reaktion von einem unedlen Metall mit einer Säure liefert neben Wasserstoff das entsprechende Salz.
- Versetzt man ein Salz mit einer Säure, deren Säurerest stärker ist als der Säurerest des Salzes, so entsteht das entsprechende Salz der stärkeren Säure.
-
Elektrochemie
(0)
-
Elektrische Spannungsquellen
(0)
-
Galvanische Zellen
(1)
Elektrochemie

Galvanische Zellen
Der italienische Naturforscher Luigi Galvani entdeckte 1782, dass frisch präparierte Muskeln von Froschschenkeln zusammenzucken, wenn sie von zwei verschiedenen, miteinander verbundenen, Metalldrähten berührt werden.
Durch die richtige Deutung dieses Experimentes wurde der Bau der ersten Batterie möglich: Um 1800 konstruierte Alessandro Volta seine Voltasche Säule, mit der er mehr als 100 V Spannung erreichte [1] (Bild links. Wikipedia, am 25.05.14 abgerufen).
Eine Apparatur, die chemische Energie in elektrische Energie umwandeln kann, nennt man eine galvanische Zelle oder galvanisches Element.
Der Begriff Element ist hier allerdings irreführend: Der Begriff "Elemente" wird ja in der Chemie für die Stoffe, die im PSE geordnet sind, verwendet.
----------------------------
[1] Prof. Blumes Bildungsserver für Chemie, Versuch: Bau einer Volta-Säule mit haushaltsüblichen Mitteln, am 05.06.14 abgerufen.
-
Galvanische Zellen
(1)
-
Elektrische Spannungsquellen
(0)
-
Säuren
(0)
-
Basic 4
(2)
Basic 4

Kohlenstoffverbindungen (1) - Organische Chemie
- Kohlenwasserstoffe - vom Campinggas zum Superbenzin (1)
-
Alkane
(0)
Kohlenwasserstoffe - vom Campinggas zum Superbenzin

Alkane
Einführung
Advanced Organizer
Verbindungen, die ausschließlich aus Kohlenstoff- und Wasserstoff-Atomen aufgebaut sind, gehören zur Verbindungsklasse der Kohlenwasserstoffe. Die einfachsten Kohlenwasserstoffe sind die sogenannten Alkane. Der einfachste Vertreter ist Methan, den du als Hauptbestandteil des Erdgases schon kennst, da du Erdgas zur Benutzung des Gasbrenners benötigst. Es gibt aber noch andere interessante Vertreter der Alkane, die du aus dem Alltag kennst.
Dieses Kapitel wird sich vor allem damit beschäftigen, dir den Zusammenhang zwischen der Struktur von Molekülen und den sich daraus ergebenen Stoffeigenschaften deutlich zu machen. Das wird z.B. bei den Siedetemperaturen der Alkane demonstriert.
- Methan (8)
-
Homologe Reihe der n-Alkane
(2)
- Siede- und Schmelzpunkte (2)
-
Unterschiedliche und gemeinsame Eigenschaften
(1)
- Brennbarkeit der n-Alkane (1)
- Rußverhalten (1)
-
Die Löslichkeit der Alkane
(1)
Kohlenwasserstoffe - vom Campinggas zum Superbenzin
- Dichte der Alkane (1)
-
Benzin und Autoabgase
(1)
- Die fraktionierende Destillation (1)
- Das Cracken (1)
- iso-Alkane (1)
- Abgasproblematik (3)
- Ringförmige Kohlenwasserstoff (1)
-
Halogenalkane
(0)
-
Synthese
(3)
Halogenalkane

Synthese
- Eigenschaften und Verwendung an Beispielen (3)
-
Das Ozonloch
(4)
Halogenalkane

Das Ozonloch
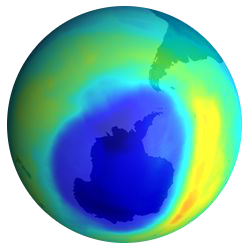
1985 veröffentlichten Forscher der britischen Antarktisstation Halley ihre Entdeckung: Das Ozonloch über der Antarktis. Es war damals eine wissenschaftliche Sensation.
1995 erhielten die Wissenschaftler Molina, Rowland und Crutzen den Nobelpreis für die vollständige Aufklärung der chemischen Vorgänge um die Zerstörung der Ozonschicht durch Chlor-Radikale.
---------------------------
Externer Link: Webcamp der Halley Research Station, Antarktis
-
Synthese
(3)
- Vergleich von Bindungstypen (1)
-
Kohlenstoffverbindungen (2) (Organische Chemie)
(0)

Basic 5
Nachdem du in Basic 4 die Grundlagen der Organischen Chemie kennengelernt hast, wirst du nun viele interessante Verbindungsklassen der Organik kennen lernen, die sich vor allem dadurch unterscheiden, dass sie ganz typische Atomgruppierungen, sogenannte funktionelle Gruppen, aufweisen.
-
Alkohole
(1)

Basic 5 Orientierung
Analyse Einführung

Advanced Organizer
Trinkalkohol entsteht durch Vergärung von zuckerhaltigen Früchten. Met, ein "Honigwein" wurde schon ca. 3000 v. Chr. im Gebiet um den Euphrat und Tigris gewonnen.
Wir haben schon bei den Alkanen eine qualitative Elementaranalyse bezüglich Wasserstoff und Kohlenstoff durchgeführt. Dies werden wir mit dem Trinkalkohol wiederholen. Außerdem werden wir den Trinkalkohol auf Anwesenheit von Sauerstoff-Atomen in den Alkohol-Molekülen untersuchen.
Neben dem Trinkalkohol gibt es noch eine Reihe von anderen, im Alltag gebräuchlichen Alkoholen, die z.B. als Frostschutzmittel, Zuckerersatzstoff oder zum Feuchthalten von Tabak Verwendung finden. All diese Verwendungsmöglichkeiten stehen in engem Zusammenhang mit den Eigenschaften dieser Alkohole bzw. mit der Strukur der Moleküle, die durch die sogenannte funktionelle Gruppe geprägt sind. Diese Zusammenhänge sollen in diesem Kapitel herausgearbeitet werden.
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links-
Im Zentrum der Unterrichtseinheit steht die Funktion der Hydroxy-Gruppe. Alle Eigenschaften und damit auch die Verwendungsmöglichkeiten der Alkohole lassen sich durch diese funktionelle Gruppe erklären.
- Die Bedeutung einer funktionellen Gruppe erklären können.
- Die Hydroxy-Gruppe in detaillierter Strukturformel (Lewisformel, Valenzstrichformel) mit Partialladungen zeichnen können.
- Die Nomenklaturregeln auf n-Akanole, iso-Alkanole und mehrwertigen Alkanolen anwenden können.
- Die Begriffe hydrophob, lipophil und hydrophil erläutern können.
- Die Eigenschaften, Bedeutung, Verwendung und Herstellung von Methanol nennen können.
- Die Eigenschaften, Bedeutung und Verwendung von Ethanol bzw. Brennspiritus nennen können.
- Die Eigenschaften, Bedeutung und Verwendung von Glykol nennen können.
- Die Eigenschaften, Bedeutung und Verwendung von Glycerin nennen können.
- Die Eigenschaften, Bedeutung und Verwendung von Sorbit nennen können.
- Erklären können, wie man mit Hilfe einer qualitativen Elementaranalyse nachweisen kann, dass in Alkohol-Molekülen Wasserstoff-, Kohlenstoff- und Sauerstoff-Atome gebunden sind.
- Den Grund für die Polarität der Hydroxy-Gruppe erklären können.
- Summenformeln von primären einwertigen Alkanolen aufstellen können.
- Strukturformeln (Vollstrukturformeln, Halbstrukturformeln und Skelettformeln) von n-Alkanolen und iso-Alkanolen (primären, sekundären und tertiären Alkoholen) und mehrwertigen Alkoholen aufstellen können.
- Das Reaktionsschema in Summenformelschreibweise für die Oxidation eines Alkanols aufstellen können.
- Das Reaktionsschema in Summenformelschreibweise für die alkoholische Gärung aufstellen können und den Prozess erklären können.
- Erklären können, warum sich leicht flüchtige Alkohole, wie z.B. Methanol, auf der Haut kühl anfühlen und daher z.B. in Duschgels Verwendung finden.
- Auf der Teilchenebene erläutern können, welche Alkohole sich als Frostschutzmittel eignen.
- Die Bedeutung von Alkoholen für Reinigungsprozesse und Löseprozesse erläutern können.
- Die Hygroskopizität einiger Alkohole erläutern können.
- Die Viskosität von bestimmten Alkoholen erläutern können.
- Die desinfizierende Wirkung von bestimmten Alkoholen erklären können.
Fachbegriffe, Stoffchemie
Fachbegriffe, Definitionen, Stoffchemie
Phänomene
Gesetzmäßigkeiten anwenden, Phänomene deuten, Reaktionsschemata aufstellen (Summenformeln, Strukturformeln, Skelettformeln)
Zusammenhänge
Vorgänge, Zusammenhänge, Funktionsweisen (im Zusammenhang mit der Bedeutung für Mensch, Tier, Pflanze und Umwelt) bewerten
Zusammenfassung
 Zusammenfassung
ZusammenfassungDie funktionelle Hydroxy-Gruppe verleiht der Stoffgruppe Alkohole (systematischer Name: Alkanole) typische (physikalische) Eigenschaften. Dies liegt vor allem daran, dass die Hydroxy-Gruppe eine polare Gruppe ist und daher mit anderen Molekülen, die polare Atomgruppierungen besitzen (andere Alkanole, Wasser), "Wasserstoffbrücken" ausbilden kann. Deshalb sieden die Vertreter der Alkanole im Vergleich zu entsprechenden Alkanen mit ähnlicher Molekülmasse erst bei höheren Temperaturen.
Kurzkettige Alkohole sind wasserlöslich (hydrophil). Je länger der Alkylrest ist, desto wasserunlöslicher (hydrophober) ist der Alkohol und desto eher löst sich der Alkohol in unpolaren Stoffen (lipophil). Während die primären, einwertigen Alkanole bis Propan-1-ol unbegrenzt wasserlöslich sind, ist Nonan-1-ol faktisch nicht mehr in Wasser löslich. Das Löslichkeitsverhalten macht man sich bei der Verwendung von Reinigungsmitteln zunutze. Hier sind insbesondere die kurzkettigen (niedermolekularen) Alkanole wichtig (Ethanol), da sie sowohl hydrophile als auch lipophile Eigenschaften besitzen. Viele medizinische Präparate werden in Ethanol gelöst.
Die Eigenschaften und die Verwendungsmöglichkeiten folgender Alkanole sollte man wissen, da sie in unserem Alltag eine Rolle spielen:
- Ethanol ist der Trinkalkohol. Wenn er vergällt wurde, spricht man von Brennspiritus. Ethanol entsteht durch Gärung von zuckerhaltigen Flüssigkeiten bei Vorhandensein von Hefebakterien. Dabei entsteht auch Kohlenstoffdioxid.
- Methanol ist ein sehr wichtiger Industrialkohol, der giftig ist. Er eignet sich sehr gut zum Reinigen von optischen Geräten, da er beim Trocknen keine Schlieren hinterlässt. Aus Methanol lässt sich Wasserstoff herstellen, der wiederum in einer Brennstoffzelle genutzt werden kann. Aus Methanol kann man sogar Eiweiß herstellen.
- Die Siedepunkte von Methanol und Ethanol liegen unterhalb der von Wasser. Sie verdunsten damit schneller (sind leicher flüchtig) und fühlen sich daher auf der Haut kühl an.
- Glycol (Ethandiol) wird als Frostschutzmittel verwendet.
- Glycerin ist der wichtigste dreiwertige Alkohol. Er dient nicht nur als Frostschutzmittel, sondern wird aufgrund seiner hygroskopischen Eigenschaften in vielen Cremes, im Tabak und in Druckfarben verwendet. Bei der Reaktion mit langkettigen Carbonsäuren (Fettsäuren) entstehen die Fette.
- Sorbit (Hexan-1,2,3,4,5,6-hexol) ist ein Zuckerersatzstoff für Diabetiker. Hier sieht man sehr schön: Je mehr Hydroxy-Gruppen die Moleküle eines Stoffes besitzen, desto süßer schmeckt er.
- Analyse des Trinkalkohols (2)
-
Nomenklatur
(3)
Alkohole

Nomenklatur der Alkanole
-
iso-Alkanole
(2)
Alkohole

Die beiden wichtigsten Vertreter der einwertigen, primären Alkanole
Iso-Alkanole
-
Mehrwertige Alkanole
(5)
- Reaktionen (2)
- Test zum Thema Alkohole (1)
-
-
Aldehyde
(0)
Aldehyde

Orientierung
Einführung
Advanced Organizer
Die ersten beiden kurzkettigen Vertreter der Aldehyde in der homologen Reihe sind besonders problematische Vertreter hinsichtlich der Gesundheitsbeeinträchtigung.
Komplizierter gebaute Aldehyde sind in ersten Linie Duft- und Aromastoffe wie z.B. die natürlichen Aromastoffe Marzipan, Vanillin, Zimt oder Geruchsstoffe von Rosen und Zitronen.
Aldehyde kann man unter bestimmten Voraussetzungen aus Alkoholen synthetisieren.
In diesem Kapitel wird erklärt, welche strukturellen Voraussetzungen bei Molekülen gegeben sein müssen, damit man den Stoff riechen kann, warum Aldehyde bei deutlich anderen Temperaturen schmelzen und sieden als vergleichbare Alkane oder Alkohole und es wird die Wasserlöslichkeit verschiedener Aldehyde im Zusammenhang mit der Struktur der Moleküle diskutiert. Es geht also hier wieder - wie bei den Alkoholen - um den Zusammenhang zwischen der Struktur der Aldehyd-Moleküle und den sich daraus ergebenen Eigenschaften der Stoffgruppe.
Außerdem wird gezeigt, dass der Begriff Oxidation auch noch eine andere sinnvolle Bedeutung hat. In diesem Zusammenhang wird erklärt, wie man Oxidationszahlen bestimmt. Dies wird auch bei den verschiedenen Nachweismethoden für Aldehyde geübt.
Kompetenzen
 Kompetenzen - Links
Kompetenzen - Links10. Klasse - ISS - G-Niveau (eBBR) => Standards des Niveaus F, wenn 2. HJ Standards des Niveaus G
10. Klasse - ISS - E-Niveau (MSA) => Standards des Niveaus G
10. Klasse - Gym => Standards des Niveaus HPhänomene
Gesetzmäßigkeiten anwenden, Phänomene deuten, Reaktionsschemata aufstellen (Summenformeln, Ionenformelschreibweise, Strukturformeln)
- Oxidationszahlen bestimmen können.
- Redoxreaktionsschemata für die Oxidation von primären Alkoholen aufstellen können.
Zusammenfassung
 Zusammenfassung
ZusammenfassungEs heißt: Der Aldehyd, die Aldehyde!
Bei der Stoffklasse der Aldehyde (systematischer Name: Alkanale, das Alkanal, die Alkanale) handelt es sich um Oxidationsprodukte der Alkohole, die man vor allem wegen ihres Geruchs kennt. Viele Aldehyde besitzen einen angenehmen Geruch. Sie sind wichtige Bestandteile vieler in der Natur vorkommender Düfte und Aromen. Nur die kurzkettigen Aldehyde besitzen einen unangenehmen Geruch.
Aldehyde schmelzen und sieden höher als vergleichbare Alkane, da aufgrund der polaren Carbonylgruppe zwischen den Molekülen Dipol-Dipol-Wechselwirkungen wirken. Da Alkohole im Gegensatz zu den Aldehyden "Wasserstoffbrücken" ausbilden können, schmelzen und sieden die Aldehyde deutlich niedriger als Alkohole mit ähnlicher Molekülmasse.
Langkettige Aldehyde besitzen einen langen unpolaren Alkyl-Rest. Da Wassermoleküle aufgrund der von ihnen ausgebildeten "Wasserstoffbrücken" zusammen bleiben wollen, drängen sie die unpolaren Alkyl-Reste weg. Langkettige Aldeyde sind also in Wasser unlöslich.
Die wichtigsten und auch bedenklichsten Aldehyde - vor allem wegen ihrer karzinogenen Wirkung - sind:
Formaldehyd (Methanal) bzw. Formaldehyd-Lösung (w > 25%)



und Acetaldehyd (Ethanal)


 .Formaldehyd findet man heute immer noch in einigen Kosmetikprodukten, da er konservierende Wirkung besitzt.
.Formaldehyd findet man heute immer noch in einigen Kosmetikprodukten, da er konservierende Wirkung besitzt.- Struktur der Aldehyde (1)
- Einge Vertreter (3)
-
3. Definition für Oxidation
(2)
Aldehyde

Die dritte Definition für Oxidation
Nachweismethoden -
Nachweismethoden
(2)
Aldehyde

Die dritte Definition
für OxidationNachweismethoden
Struktur und Eigenschaften -
Struktur und Eigenschaften
(1)
Aldehyde

Nachweismethoden Struktur und Eigenschaften
Test zum Kapitel Aldehyde
- Ketone (2)
-
Organische Säuren
(0)

Orientierung
Einführung
Advanced Organizer
Erinnern wir uns: Säuren sind nach Arrhenius Stoffe, die Wasserstoff-Ionen abspalten können. Nach Brönsted sind Säuren Stoffe, die Wasserstoff-Ionen (Protonen) abgeben können, wenn Stoffe vorhanden sind, die Protonen aufnehmen können. Organische Säuren müssen also Kohlenstoffverbindungen sein, die diese Eigenschaft bzw. Funktion besitzen. Die Kohlensäure gehört jedoch - aus historischen Gründen - nicht zu den Organischen Säuren.
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links
- Das Prinzip der Oxidationszahlen wiederholt an einer neuen Stoffgruppe anwenden können.
- Das Dissoziationsschema für eine Carbonsäure aufstellen können und die Bedeutung im Sinne von Arrhenius erkennen können.
- Carbonsäuren des Alltags nennen können und deren Eigenschaften und Verwendungsmöglichkeiten mit Hilfe der Strukturkenntnis erläutern können.
- Die Siedepunkte der Carbonsäuren im Vergleich zu den bisher vermittelten Stoffklassen diskutieren können.
- Die Löslichkeit der Carbonsäuren in einem unpolaren oder polaren Lösemittel erläutern können.
- Die Reaktion einer Carbonsäure mit einem unedlen Metall oder mit Kalk in Form eines Reaktionsschemas darstellen können.
- Eine Titration mit Natronlauge zur Bestimmung des Säuregehaltes von Joghurt durchführen, erläutern und auswerten können (noch im Aufbau).
-
Carbonsäuren
(1)

Orientierung
Einführung
Advanced Organizer
Bleibt Wein lange Zeit offen stehen, bildet sich Essig: Ethanol wird zu Essigsäure (Ethansäure) oxidiert. Essig kann man nicht nur zum Würzen benutzen, sondern auch z.B. zum Desinfizieren von Trinkwasser.
In diesem Kapitel wirst du nicht nur weitere Carbonsäuren kennenlernen, du wirst auch wieder den Zusammenhang zwischen den Molekülstrukturen und den sich daraus ergebenden Eigenschaften des Stoffes erkennen. So werden die Siedetemperaturen der Carbonsäuren mit denen anderer bisher besprochenen Stoffklassen verglichen und es wird vor allem die Löslichkeit der Carbonsäuren in Wasser diskutiert.
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links- Das Prinzip der Oxidationszahlen wiederholt an einer neuen Stoffgruppe anwenden können.
- Das Dissoziationsschema für eine Carbonsäure aufstellen können und die Bedeutung im Sinne von Arrhenius erkennen können.
- Carbonsäuren des Alltags nennen können und deren Eigenschaften und Verwendungsmöglichkeiten mit Hilfe der Strukturkenntnis erläutern können.
- Die Siedepunkte der Carbonsäuren im Vergleich zu den bisher vermittelten Stoffklassen diskutieren können.
- Die Löslichkeit der Carbonsäuren in einem unpolaren oder polaren Lösemittel erläutern können.
- Die Reaktion einer Carbonsäure mit einem unedlen Metall oder mit Kalk in Form eines Reaktionsschemas darstellen können.
- Eine Titration mit Natronlauge zur Bestimmung des Säuregehaltes von Joghurt durchführen, erläutern und auswerten können (noch im Aufbau).
- Vorkommen und Verwendung (1)
-
Essig
(1)
- Slide (3)
- Eigenschaften (2)
- Weitere Carbonsäuren / Nomenklatur (7)
- Test zum Thema Alkansäuren (1)
- Teste Dein Wissen (II) (1)
- Das Prinzip der Oxidationszahlen wiederholt an einer neuen Stoffgruppe anwenden können.
-
Aminosäuren
(0)
Aminosäuren

Orientierung
Einführung
Advanced Organizer
Eiweiße (Eiweißstoffe), wissenschaftlich Proteine genannt, sind aus über 100 Aminosäurebausteinen aufgebaut [1]. Dabei werden bis zu 22 unterschiedliche Aminosäuren benutzt [2], wodurch sich eine extrem große Kombinationsmöglichkeit ergibt. Jeder Mensch besitzt individuelle Proteine. Dies ist auch ein Grund dafür, dass es bei Organtransplantationen so viele Probleme gibt.
Proteine übernehmen sehr wichtige und auch sehr unterschiedliche Funktionen im Organismus. Folgende Protein-Gruppen sollen das verdeutlichen: Hormone, Enzyme, Haare, Nägel, Sehfarbstoffe, Hautpigmente, Bestandteile von Muskelfasern u.a.
Die Proteine, die wir mit der Nahrung aufnehmen, werden vom Körper in die Aminosäuren zerlegt, die dann durch den Darm aufgenommen werden und die schließlich in den Zellen zu neuen Proteinen kombiniert werden (Biosynthese der Proteine). Viele Aminosäuren können vom Körper selbst hergestellt werden. Andere müssen wir mit der Nahrung aufnehmen (essenzielle Aminosäuren).
Weiterführende Informationen zu den Themen dieses Kapitels findet man im Unterrichtsblock "Grundkurs 1. HJ".
----------------
[1]: Moleküle, die aus weniger als 100 Aminosäurebausteinen aufgebaut sind, nennt man Peptide.
[2]: Lange Zeit waren nur 20 proteinogene Aminosäuren bekannt. Nach neueren Erkenntnisse zählen auch die Aminosäuren Selenocystein (Sec) und L-Pyrrolysin dazu. Quelle: Römpp USB Stick · 2008
ISBN: 978-3-13-149231-9 und Hao, B.; Gong, W.; Ferguson, T. K.; James, C. M.; Krzycki, J. A.; Chan, M. K., Science, (2002) 296, 1462-1466.Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links
Im Unterricht erhältst du für die unten aufgeführten Kompetenzgebiete eine Checkliste, mit der du dein selbständiges Arbeiten strukturieren kannst.
Wenn du unten auf die Links klickst, kommst du direkt zu den Stellen der Website, an denen die entsprechenden Inhalte behandelt werden.
Anknüpfungen
 Anknüpfungen - Links
Anknüpfungen - Links
- Basischer und saurer Charakter von Aminosäuren
- Die Zwitterform (pH-Abhängigkeit)
- Mesomere Grenzformen der Peptidbindung und deren Konsequenz
- Das Prinzip der Oxidationszahlen wiederholt an einer neuen Stoffgruppe anwenden können.
-
Ester
(1)
-
Duft und Aromastoffe
(3)
Ester

Duft- und Aromastoffe
Mehr zu diesem Thema (z.B. Herstellung von Rasierwasser etc.) findet man
im Kapitel "Duftstoffe" (Wahlpflicht - Kl. 10). - Wachse (1)
- Polyester (3)
-
Duft und Aromastoffe
(3)
-
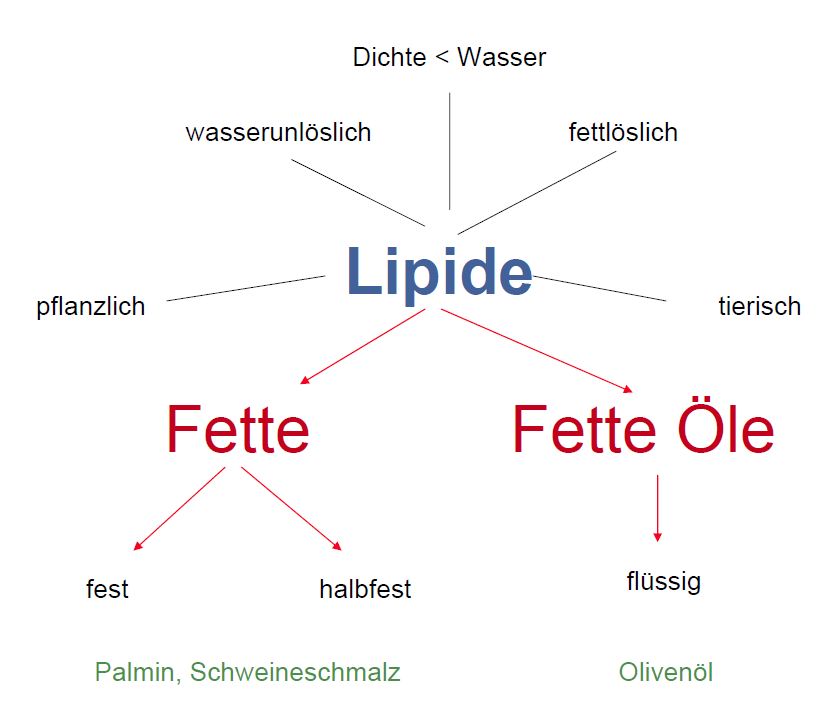
Fette
(0)
Fette

Orientierung
Fett hat als Energie liefernder Nährstoff eine besondere Bedeutung für den Organismus. Dabei werden die Fettsäuren unter Energiegewinnung verbrannt. Fett, das in Depotfett umgewandelt wird, dient dem Körper als Energiereserve und als Wärmeschutz.
Fette sind Träger und Vermittler von Geschmacksstoffen und Aromen.
Überblick:
Der Begriff "Öle" ist chemisch betrachtet nicht eindeutig. Mineralöle sind reine Kohlenwasserstoffe. Fette Öle sind Triglyceride. Ätherische Öle sind Terpene. Silikonöle sind Siliciumverbindungen.
Der Begriff Öl ist vielmehr eine physikalische Stoffeigenschaft.
Öle sind viskose Flüssigkeiten, die sich so gut wie gar nicht in Wasser lösen.
- Aufbau von Fetten (2)
- Eigenschaften von Fetten (1)
-
Fetthärtung
(2)
Fette

Fetthärtung

-
Seifen
(0)
Seifen

Fetthärtung Orientierung

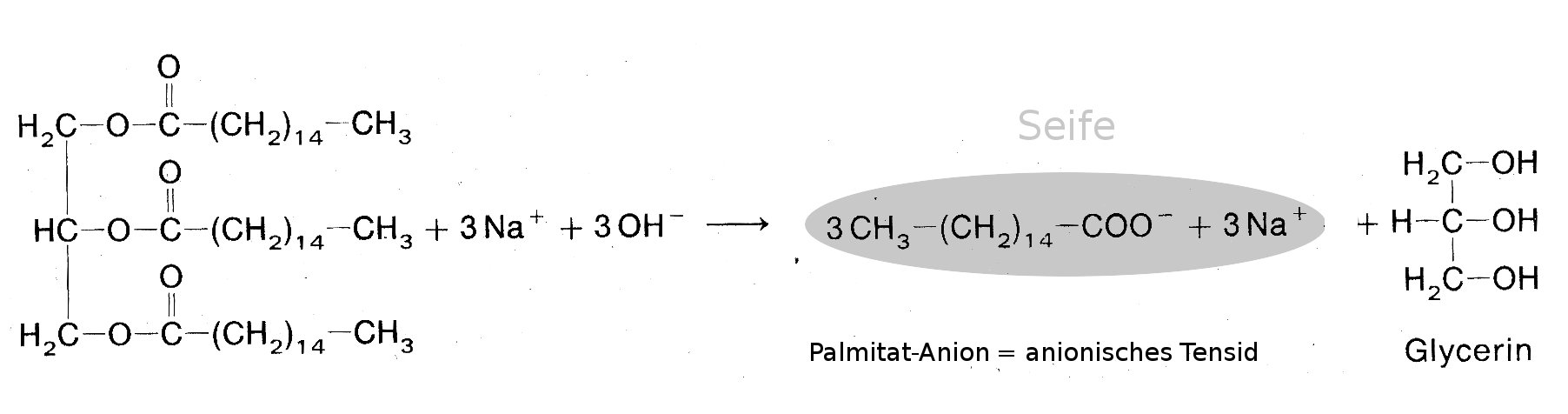
Durch Erhitzen in alkalischen Lösungen werden Fette (Fettsäureglycerinester) in den Alkohol Glycerin und Fettsäurereste (Anionen) gespalten. Diesen Vorgang nennt man Verseifung. Die Fettsäure-Anionen bilden mit Kationen Salze. Die Salze der Fettsäuren nennt man Seife. Natriumsalze der Fettsäuren bilden die Kernseife, Kaliumsalze der Fettsäuren bilden die Schmierseife.
Beispiel: Verseifung von Palmitin (Triglycerinester der Palmitinsäure) mit Natronlauge
Alkalische Lösungen erhält man z.B.
- mit Natriumhydrogencarbonat (Natron):
Natriumhydrogencarbonat + Wasser → Natriumcarbonat + Wasser + Kohlenstoffdioxid
2 NaHCO3 + H2O → Na2CO3 + H2O + CO2
Zwar bildet Kohlenstoffdioxid mit Wasser die schwache Kohlensäure (H2CO3), doch Natriumcarbonat (Soda) bildet mit Wasser die Natronlauge:
Natriumcarbonat + Wasser → Natriumhydrogencarbonat + Natronlauge
Na2CO3 + H2O → NaHCO3 + NaOH
Eine 10%ige Natronlösung hat dadurch einen pH-Wert von 8. Die Lösung kann alkalischer werden, wenn Kohlenstoffdioxid vermehrt aus der Lösung entweicht. Das geschieht durch Erhitzen der Lösung.
- mit Natriumcarbonat (Soda):
Wie man an dem Reaktionsschema oben sehen erkennt, kann man auch gleich Natriumcarbonat verwenden.
Entscheidend ist die Einstellung des folgendes Gleichgewichtes:
CO32-(aq) + H2O(l)
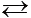 HCO3- + OH-(aq)
HCO3- + OH-(aq)- mit Kaliumcarbonat (Pottasche):
Kaliumcarbonat + Wasser → Kaliumhydrogencarbonat + Kaliumlauge (Kalilauge)
K2CO3 + H2O → KHCO3 + KOH
- mit faulendem Urin:
Die Römer reinigten stark verschmutzte Wolle mit faulendem Urin. Urin enthält Harnstoff. Bei der Hydrolyse entsteht eine Lösung von Ammoniumcarbonat. Die Lösung reagiert alkalisch und riecht nach Ammoniak.
CO(NH2)2(aq) + 2 H2O(l) → (NH4)2CO3(aq)
NH4+(aq) + CO32-(aq)
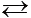 NH3(aq) + HCO3-(aq)
NH3(aq) + HCO3-(aq)Ammoniak kann Protonen aufnehmen, ist also nach Brönsted eine Base:
NH3(aq) + H2O(l)
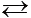 NH4+(aq) + OH-(aq)
NH4+(aq) + OH-(aq)Fette können aber auch gleich mit Natronlauge oder Kalilauge verseift werden (Neutralisationsreaktion).
-
Herstellung
(1)
Seifen

Orientierung Herstellung
Waschwirkung 
-
Alkohole
(1)
-
Wahlpflicht - Kl. 10
(0)

Orientierung
Forensik 

Was bedeutet Wahlpflicht?
Im günstigsten Fall wirst du ein Thema aus folgendem Pool wählen können:
- Faserstoffe - Versponnen aus Natur und Labor
- Kriminalistische Untersuchungsmethoden
- Baustoffe
- Duftstoffe
Du wirst nachvollziehen können, dass deine Lehrerin bzw. dein Lehrer aufgrund des Aufwandes in der Vorbereitung in der Regel zur Auswahl das anbieten wird, was sich in den vorangegangenden Jahren bewährt hat. Letztendlich wirst du, egal welches Thema nun im Unterricht behandelt wird, auf das naturwissenschaftliche Arbeiten in der Oberstufe vorbereitet.
-
Forensik
(1)
Forensik

Orientierung
Fäulnis und Verwesung Nichts für schwache Nerven
 Im antiken Rom fand die Rechtssprechung auf dem Marktplatz, einem öffentlichen Versammlungsort, statt. Einen solchen Platz nannten die Römer "Forum" (Mehrzahl: Foren).
Im antiken Rom fand die Rechtssprechung auf dem Marktplatz, einem öffentlichen Versammlungsort, statt. Einen solchen Platz nannten die Römer "Forum" (Mehrzahl: Foren).Demzufolge bezeichnet forensisch alles, was mit der Rechtssprechung, also dem Gericht zugehörig, zu tun hat.
forensis, lat.: Zum Gericht gehörend
Die forensische Wissenschaft besteht aus verschiedenen Teilgebieten, die sich aber auch überschneiden:
- Rechtsmedizin
- Biologie
- Physik mit den Bereichen der Ballistik, Werkstoff- und Elektrotechnik
- Chemie mit Toxikologie, Daktyloskopie und Sprengstoffanalytik
-
Fäulnis und Verwesung
(3)
Forensik

Fäulnis und Verwesung
Konservierung 
"Ein menschlicher Körper beginnt fünf Minuten nach dem Tod zu verwesen. Der Körper, einst die Hülle des Lebens, macht nun die letzte Metamorphose durch. Er beginnt sich selbst zu verdauen. Die Zellen lösen sich von innen nach außen auf. Das Gewebe wird erst flüssig, dann gasförmig.
Kaum ist das Leben aus dem Körper gewichen, wird er zu einem gigantischen Festschmaus für andere Organismen. Zuerst für Bakterien, dann für Insekten. Fliegen. Aus den gelegten Eiern schlüpfen Larven, die sich an der nahrreichen Substanz laben und dann abwandern. Sie verlassen die Leiche in Reih und Glied und folgen einander in einer ordentlichen Linie, die sich immer nach Süden bewegt. Manchmal nach Südosten oder Südwesten, aber niemals nach Norden. Niemand weiß, warum."Aus: Simon Beckett, die Chemie des Todes, Rowohlt Taschenbuch Verlag, 2007, S. 7
Ein Organismus zerfällt innerlich, bei Abwesenheit von Sauerstoff, durch Fäulnisprozesse, äußerlich bei Anwesenheit von Sauerstoff durch Verwesungsprozesse. - Geschichte der Forensik (1)
-
Daktyloskopie
(2)
Forensik

Daktyloskopie
DNA-Test 

Die Daktyloskopie (griechisch daktylos, Finger) ist die Fingerabdruck-Methode.
Aufgrund dieser Unverwechselbarkeit und des Umstandes, dass sich die Furchen an den Fingerspitzen im Laufe des Lebens nur geringfügig verändern [1], ist die Daktyloskopie auch heute noch eine der wichtigsten Methoden in der Kriminologie.
WILLIAM J. HERSCHEL (1833 - 1918) [2] war der erste Europäer, der dies zur Identifizierung von Personen nutzen wollte. Er gilt daher als Begründer der Daktyloskopie. Einer Anekdote zufolge entlarvte er durch einen Fingerabdruck auf seiner Likörflasche seinen Diener als heimlichen Mittrinker.
Nicht einmal eineiige Zwillinge besitzen die gleichen Fingerabdrücke.--------------
- [1] Auch die Fingerabdrücke verändern sich langsam, 3sat nano, abgerufen am 1.4.12
- [2] WILLIAM JAMES HERSCHEL, Wikipedia, abgerufen am 1.4.12
-
Gundkurs 1. HJ || Chemie im Menschen
(0)
Chemie im Menschen - Von Atomen zu Makromolekülen

Einleitung
Es geht in diesem Halbjahr vor allem um den Aufbau der Materie, ihre Struktur und ihre Eigenschaften. Hieraus werden chemische Reaktionen erst verständlich. Dieser Block bildet die Grundlage auch für die kommenden Semester. Außerdem möchte ich Ihnen hier den Blick für die fachübergreifenden philosophischen Dimensionen dieser Naturwissenschaft öffnen.
Ein Schwerpunkt des Unterrichts werden makromolekulare Stoffe wie Polysaccharide und Proteine sein.
-
Aufbau der Materie
(0)
Aufbau der Materie

Orientierung
Einführung
 Advanced Organizer
Advanced OrganizerWir haben in der Mittelstufe schon einige Vorstellungen vom Atombau kennen gelernt. Hierbei zeichnete sich ab, dass vor allem die Valenzelektronen für die Betrachtung von chemischen Bindungen von Bedeutung sind. Für den Chemiker stellt sich weniger die Frage, wie ein einzelnes Atom aufgebaut ist (dies ist Thema eines Atomphysikers), sondern wie Atomverbände zustande kommen; also: wie Bindungen entstehen.
Wir werden in diesem Kapitel die Grenzen des Schalenmodells herausarbeiten und Modellvorstellungen kennen lernen, die das Zustandekommen von Bindungen differenzierter erklären.
Nötige Vorkenntnisse

Nötige Vorkenntisse - Links
- Die Grundbegriffe Element, Verbindung, Molekül, Atomverband, Ionenverband (Ionengitter), Reinstoff, Gemisch erklären können.
- Aufbau der Materie: Die ersten Naturphilosophen
- Atommodelle: Demokrit, Dalton, Rutherfordscher Streuversuch, das Schalenmodell, Bindungsmodell mit Hilfe des Schalenmodells (Atombindung), Bindungsmodell mit Hilfe des Schalenmodells (Ionenbindung)
- Polare Atombindung, Elektronegativität, Elektronegativitätsdifferenz, Partialladungen (Teilladungen)
- Mit Hilfe des Schalenmodells (erweitertes Kern-Hülle-Modell von Bohr) Atome, Ionen und Moleküle (z.B. Wasser) zeichnen können und die hierzu nötigen Informationen aus dem PSE entnehmen können.
- Aufstellen von Summenformeln und Verhältnisformeln in Ionenformelschreibweise
- Einfache Lewisformeln (Valenzstrichformeln, Strukturformeln) aufstellen können.
- Die Säurereste der wichtigsten Säuren mit Namen und Formel kennen.
- Das Elektronenpaarabstoßungs-Modell von GILLESPIE anwenden können.
- Zwischenmolekulare Kräfte: Van-der-Waals-Kräfte, Wasserstoffbrücken (Dipol-Dipol-Wechselwirkungen)
- Optional: Das Kugelwolkenmodell
- Optional: Bindungsmodell mit Hilfe des Kugelwolkenmodells (Atombindung, Ionenbindung)
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links- Erkennen, dass Modelle für spezifische Fragestellungen bzw. spezifische Problemstellung entworfen werden. Sie bilden nicht die Wirklichkeit ab. Erkennen, dass Modelle demzufolge Grenzen haben.
- Erkennen, dass das Atommodell von Niels Bohr (Schalenmodell) das Zustandekommen von Bindungen und die sich daraus auch ergebenen Strukturen, also bzw. Geometrie von Molekülen nicht plausibel erklären kann.
- Mit Hilfe des Orbital-Modells Bindungsverhältnisse beschreiben können (z.B. Methan, Ethan, Ethen, Butadien).
Phänomene / Zusammenhänge
Gesetzmäßigkeiten anwenden, Phänomene deuten und anhand Modellen beschreiben
- Die Deutung der Naturphilosophen (Demokrit, Empedokles) von Materie beschreiben können.
- Die fünf Fundamentalaussagen von Dalton im Zusammenhang mit der heutigen Gültigkeit diskutieren können.
- Die Flammenfarbe beim Nachweis von Metall-Ionen (Flammenprobe) mit Hilfe des Bohrschen Atommodells erklären können.
- Lewis-Formeln von komplizierteren Molekülen oder Anionen unter Berücksichtigung von mesomeren Grenzstrukturformeln aufstellen können.
- s-, p- und Hybrid-Orbitale zeichnen können
- Energiediagramme verschiedener Atome in Kästchenschreibweise zeichnen und ein entsprechendes Termschema und die Elektronenkonfiguration (auch in verkürzter Schreibweise) aufstellen können.
- Die Elektronenkonfigurationsmöglichkeiten eines Kohlenstoffatoms in einem Termschema angeben und die entsprechenden Orbitale skizzieren können.
- Das Zustandekommen von Bindungen mithilfe der Valence-Bond-Theorie erklären können.
- Das Zustandekommen von Doppelbindungen zwischen Kohlenstoff-Atomen mit Hilfe der sp
- Erklären können, unter welchen Umständen ein delokalisiertes π-Elektronensystem entsteht und die Bedeutung für den Bewegungsraum dieser π-Elektronen nennen können.
-
Atommodelle
(1)
-
Das Bohrsche Atommodell
(2)
Aufbau der Materie

Atommodelle Das Atommodell von Niels Bohr
Quantenmechanik und Wellenmechanik - Quantenmechanik und Wellenmechanik (1)
-
Orbital-Modell
(3)
-
Elektronenkonfiguration der Haupt- und Nebengruppenelemente
(1)
Aufbau der Materie

Orbitaltheorie Elektronenkonfiguration der Haupt- und Nebengruppenelemente
Aus heutiger Sicht
-
Elektronenkonfiguration der Haupt- und Nebengruppenelemente
(1)
- Aus heutiger Sicht (1)
-
Das Bohrsche Atommodell
(2)
-
Bindungsmodelle
(6)
-
Kohlenstoffverbindungen
(1)
- Methan (1)
- Ethan (1)
- Ethen (1)
- Ethin (1)
- Butadien / Mesomerie (2)
- Bindungsverhältnisse beim Benzol (1)
-
Kohlenstoffverbindungen
(1)
-
Orientierung - Kohlenhydrate
(0)
Kohlenhydrate

Orientierung
Einführung
 Advanced Organizer
Advanced OrganizerNeben den Lipiden, Proteinen und Nucleinsäuren zählen die Kohlenhydrate (umgangssprachlich: Zucker; wissenschaftlich: Saccharide) zu den wichtigsten Biomolekülen. Die Kohlenhydrate sind Energiestoffe bzw. Energiespeicherstoffe für Lebewesen bzw. ihrer Zellen. Auch als Baustoffe, besonders in Pflanzen, erfüllen sie wichtige Aufgaben.
Mit dem Namen verbindet man den süßen Geschmack. Es gibt jedoch auch Zucker, die ihren süßen Geschmack erst nach längerem Kauen bekommen.
Übermäßiger Zuckerkonsum ist mit Nachteilen verbunden. Als Alternative werden daher Zuckerersatzstoffe (Zuckeraustauschstoffe und Süßstoffe) angeboten.
Dies ist also eine Unterrichtseinheit, die wieder einmal unseren Alltag von der chemischen Seite her beleuchtet. Und das meint: Wir werden auch diesmal den Zusammenhang zwischen der Struktur der Stoffe und deren Auswirkungen auf die Eigenschaften beleuchten.
Nötige Vorkenntnisse

Nötige Vorkenntisse - Links
- Strukturformelschreibweise (Lewisformeln), (auch: Skelettstrukturformelschreibweise) von organischen Verbindungen zeichnen können.
- Polare Atombindung, Elektronegativitätsdifferenz
- Hydroxy-Gruppe
- Carbonyl-Gruppe
- Aldehyd-Gruppe
- Keto-Gruppe
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links- Ich kann wichtige Vertreter der Kohlenhydrate mit Trivialnamen und wissenschaftlichen Namen nennen. Zudem kann ich Auskunft über das Vorkommen und die Bedeutung (Funktion für Menschen, Tiere oder Pflanzen) machen.
- Ich kann die gemeinsamen Strukturmerkmale von Kohlenhydrat-Molekülen erkennen und benennen.
- Ich erkenne sowohl die Fischer- und die Haworth-Projektion, als auch die Sesselform.
- Ich kann für die D-Glucose die Formel der Fischer-Projektion zeichnen und die Summenformel schreiben.
- Ich kann folgende Begriffe erläutern: Aldose, Ketose, Enantiomer, Anomer bzw. Diastereomer, Mutarotation, Pyranose, Furanose.
- Ich kann Kohlenhydrate nach Einfach- Zweifach und Mehrfachzucker ordnen und erkenne eine glycosidische Bindung.
- Ich kann die Fehling- und die Tollensprobe durchführen, beschreiben und die chemischen Abläufe bei diesen Nachweismethoden mit Hilfe von Reaktionsschemata, die Oxidationszahlen beinhalten, erläutern.
Zusammenfassung

Zusammenfassung - Kohlenhydrate
Man unterscheidet zwischen Einfachzuckern, bei denen die Moleküle nur aus einem Kohlenstoff-Ringsystem bestehen, Zweifachzuckern (ihre Moleküle bestehen aus zwei Ringsystemen) und Mehrfachzuckern, auch Polysaccharide oder Vielfachzucker genannt, deren Moleküle aus vielen - mindestens 10 - Ringsystemen aufgebaut sind.
Die Einfachzucker sind die Bausteine der Polysaccharide.
Alle Zucker sind farblos oder weiß. Diejenigen mit geringer Molekülmasse sind sehr gut wasserlöslich.
- Wichtige Vertreter (6)
- Struktur (1)
- Stereoisomerie (1)
- Opitsche Aktivität (1)
- Saure Hydrolyse (1)
- Energiegewinnung (1)
- Zuckerersatzstoffe (2)
-
Proteine
(0)
Proteine

Orientierung
Einführung
 Die Aminosäuren können untereinander zu längeren Molekülketten reagieren. Auf diese Weise entstehen erst Dipeptide (aus zwei Aminosäuren), und Polypeptide. Molekülketten, die sich aus mindestens 100 Aminosäurebausteinen zusammensetzen, werden Proteine (Eiweißstoffe) genannt.
Die Aminosäuren können untereinander zu längeren Molekülketten reagieren. Auf diese Weise entstehen erst Dipeptide (aus zwei Aminosäuren), und Polypeptide. Molekülketten, die sich aus mindestens 100 Aminosäurebausteinen zusammensetzen, werden Proteine (Eiweißstoffe) genannt.Nötige Vorkenntnisse
 Nötige Vorkenntnisse - Links
Nötige Vorkenntnisse - Links
- Inhalte der Unterrichtseinheit: Aminosäuren und Eiweiße (Basic 5, 10. Klasse).
- Zwischenmolekulare Kräfte (van-der-Waals-Kräfte; "Wasserstoffbrücken") erläutern und anwenden können.
- ElektronegativitätLex und Elektronegativitätsdifferenz erklären und anwenden können.
- Das Zustandekommen einer Atombindung und Ionenbindung erläutern können.
- Die Säuretheorie von Arrhenius erklären und anwenden können.
- Lewis-Formeln von Stoffen bzw. Teilchen herleiten und zeichnen können.
- Das Prinzip einer Veresterung mit Hilfe von Strukturformeln darstellen können.
- Das Prinzip eines chemischen Gleichgewichts erläutern können.
- Die Doppelbindung mit Hilfe der Orbitaltheorie erläutern können.
- Den Begriff Mesomerie erläutern können
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links
Im Unterricht erhältst du für die unten aufgeführten Kompetenzgebiet eine Pensenliste, mit der du dein selbständiges Arbeiten strukturieren kannst. Die hier angegebenen Lernziele waren zum Teil auch schon Inhalt der 10. Klasse (Aminosäuren, Peptide und Proteine).
"Alte" Lernziele, die in dieser Unterrichtseinheit noch einmal geübt werden, sind im Folgenden mit dem Zeichen
 versehen.
versehen.Wenn du unten auf die Links klickst, kommst du direkt zu den Stellen der Website, an denen die entsprechenden Inhalte behandelt werden.
Stoffe
Eigenschaften, Struktur, Summenformel, Bedeutung für Mensch, Pflanze, Tier, Umwelt
 Ich kann den prinzipiellen Aufbau eines Aminosäure-Moleküls mit Hilfe der detaillierten Valenzstrichformelschreibweise, also auch mit Teilladungen, zeichnen.
Ich kann den prinzipiellen Aufbau eines Aminosäure-Moleküls mit Hilfe der detaillierten Valenzstrichformelschreibweise, also auch mit Teilladungen, zeichnen. Ich kann die Bedeutung der Seitenkette von einer Aminosäure erklären.
Ich kann die Bedeutung der Seitenkette von einer Aminosäure erklären.- Ich kann folgende Stoffe anhand ihrer funktionellen Gruppe erkennen und zuordnen und ich kann auch diese funktionellen Gruppen in Strukturformelschreibweise zeichnen:
 Ester, Carbonsäuren, Aminosäuren, Peptide
Ester, Carbonsäuren, Aminosäuren, Peptide
Amide, Amine, Ammonium-Gruppe, Carboxylat-Gruppe. - Ich kann Aminosäuren entsprechend ihrer Seitenketten in polare, apolare, aliphatische und aromatische Aminosäuren einteilen.
 Ich kann Aminosäuren experimentell nachweisen und das Experiment hierzu protokollieren.
Ich kann Aminosäuren experimentell nachweisen und das Experiment hierzu protokollieren.- Ich kann zwei Besonderheiten der Peptidbindung ("Wasserstoffbrücken"-Bildung, planare Struktur) beschreiben und erläutern. Außerdem kann ich die Konsequenz dieser Besonderheiten für den Bau von Polypeptiden beschreiben.
Fachbegriffe
Fachbegriffe, Definitionen, Personen
 Ich kann Peptide folgender Überschriften zuordnen: Dipeptide, Tripeptide, Oligopeptide, Polypeptide und Proteine.
Ich kann Peptide folgender Überschriften zuordnen: Dipeptide, Tripeptide, Oligopeptide, Polypeptide und Proteine. Ich kann folgende Fachbegriffe definieren: Alkyl-Rest, alkalisch, basisch, sauer.
Ich kann folgende Fachbegriffe definieren: Alkyl-Rest, alkalisch, basisch, sauer.- Ich kann folgende Fachbegriffe definieren: Ampholyt, Substituent, Derivat, Oxonium-Ionen, aliphatisch, aromatisch.
- Ich kann den Begriff "Kondensationsreaktion" erklären.
- In kann den Unterschied zwischen den Begriffen "intermolekular" und "intramolekular" erklären.
- Ich kann den Begriff "isoelektrischer Punkt" erklären.
Phänomene
Gesetzmäßigkeiten anwenden, Phänomene deuten, Reaktionsschemata aufstellen (Summenformeln, Ionenformelschreibweise, Strukturformeln)
- Ich kann erklären, wieso sich Glycin beim Erhitzen vor dem Schmelzen zersetzt.
- Ich kann für die Reaktion zweier ausgewählter Aminosäuren das Reaktionschema in Strukturformelschreibweise zeichnen.
- Ich kann die Trennmethode Elektrophorese erklären.
Zusammenhänge
Vorgänge, Zusammenhänge, Funktionsweisen (im Zusammenhang mit der Bedeutung für Mensch, Tier, Pflanze und Umwelt) bewerten
- Ich kann in wenigen Sätzen sagen, um welche Inhalte es im Wesentlichen bei dieser Unterrichtseinheit geht.
 Ich kann über die Bedeutung von Aminosäuren für den Menschen in einer freien Rede umfassend Auskunft geben und Beispiele nennen.
Ich kann über die Bedeutung von Aminosäuren für den Menschen in einer freien Rede umfassend Auskunft geben und Beispiele nennen. Ich kann die Problematik von Natriumglutamat und Aspartam beschreiben.
Ich kann die Problematik von Natriumglutamat und Aspartam beschreiben.- Ich kann den amphoteren Charakter von Wasser und von Aminosäuren erläutern.
- Inhalte der Unterrichtseinheit: Aminosäuren und Eiweiße (Basic 5, 10. Klasse).
-
Aufbau der Materie
(0)
-
Gundkurs 2. HJ || Chemie am Menschen
(0)
Chemie am Menschen

Orientierung
 Die Welt ist bunt!
Die Welt ist bunt!Doch warum? Welchen Zusammenhang gibt es zwischen der Farbigkeit eines Stoffes und der chemischen Struktur des Stoffes? Welche zusätzlichen Eigenschaften von Farbmitteln und Faserstoffen bestimmen deren Verwendungsmöglichkeiten? Welche wichtigen Färbeverfahren gibt es und inwieweit können sie die Umwelt und die Gesundheit gefährden?
Auch beim Thema Kunststoffe werden wir den engen Zusammenhang zwischen Struktur und Eigenschaften herausarbeiten, Herstellungsverfahren kennenlernen und einige Aspekte hinsichtlich des Umgangs mit Kunststoffen diskutieren.
-
Farbmittel und Textilien
(0)
Chemie am Menschen - Farbmittel und Textilien

Chemie am Menschen Orientierung
Einführung

Advanced Organizer
Thematische Übersicht
Station 1: Licht und Farbigkeit
Aneignung von allgemeinem Grundlagenwissen, Themenschwerpunkt: Berliner Blau
Station 2: Struktur von Farbstoffmolekülen
Erarbeitung von Kenntnissen über den Zusammenhang zwischen der Struktur von Farbstoffmolekülen und dessen Farbigkeit
Station 3: Färbeverfahren
Wechselwirkung zwischen Textilien und Farbmitteln
-
Licht und Farbigkeit
(4)
Chemie am Menschen - Farbmittel und Textilien

Farbmittel und Textilien Licht und Farbigkeit
-
Theorie der Farbigkeit
(3)
Chemie am Menschen - Licht und Farbigkeit

Licht und Farbigkeit Theorie der Farbigkeit
-
Wenn Atome Energie aufnehmen
(1)
Chemie am Menschen - Licht und Farbigkeit

Theorie der Farbigkeit Wenn Atome Energie aufnehmen
-
Farbpigmente
(1)
Chemie am Menschen - Licht und Farbigkeit

Wenn Atome Energie aufnehmen Farbpigmente
 Es gibt Stoffe, die nehmen aus dem sichtbaren Farbspektrum bestimmte Anteile auf. Der nicht absorbierte Teil des Lichtes addiert sich zur komplementären Eigenfarbe des farbigen Stoffes.
Es gibt Stoffe, die nehmen aus dem sichtbaren Farbspektrum bestimmte Anteile auf. Der nicht absorbierte Teil des Lichtes addiert sich zur komplementären Eigenfarbe des farbigen Stoffes.Farbpigmente sind z.B. solche Stoffe.
Unter Farbpigmente versteht man wasserunlösliche anorganische Farbmittel. Sie können in Wasser oder Öl kolloidal verteilt werden.
-
Theorie der Farbigkeit
(3)
-
Struktur von Farbstoffmolekülen
(2)
Chemie am Menschen - Struktur von Farbstoffmolekülen

Test zum Kapitel "Licht und Farbigkeit" Orientierung
Nötige Vorkenntnisse
Pensenliste
 Nötige Vorkenntnisse - Links
Nötige Vorkenntnisse - Links- Atombindung
- Valenzstrichformelschreibweise
- Wichtige funktionelle Gruppen
- gesättigte und ungesättigten Verbindungen
- Bindungsverhältnisse beim Butadien
- Löslichkeit von Stoffen
- Brennverhalten (Rußen) von Stoffen
- ungesättigte Fettsäuren
- Fetthärtung
-
Lichtabsorption von organischen Verbindungen
(1)
Chemie am Menschen - Struktur von Farbstoffmolekülen

Struktur von Farbstoffmolekülen Lichtabsorption von organischen Verbindungen
-
Der bathochrome und der hypsochrome Effekt
(3)
Chemie am Menschen - Struktur von Farbstoffmolekülen

Lichtabsorption von organischen Verbindungen Der bathochrome und der hypsochrome Effekt
-
Ausgewählte Farbstoffgruppen
(3)
Chemie am Menschen - Struktur von Farbstoffmolekülen

Der bathochrome und der hypsochrome Effekt Ausgewählte Farbstoffgruppen
- Atombindung
-
Färbeverfahren
(1)
Chemie am Menschen - Färbeverfahren

Test zum Kapitel Überblick
-
für natürliche Textilfasern
(2)
Chemie am Menschen - Färbeverfahren

Färbeverfahren - Überblick Für natürliche Textilfasern
-
für natürliche Textilfasern
(2)
-
Licht und Farbigkeit
(4)
-
Kunststoffe
(0)
Chemie am Menschen - Kunststoffe

Färbeverfahren für synthetische Textilfasern Orientierung
Einführung
Advanced Organizer
 Unsere Welt ist ohne Kunststoffe heute nicht mehr vorstellbar. Doch was genau ist eigentlich ein Kunststoff? Kunststoffe bestehen aus sehr großen Molekülen (Makromolekülen), so wie viele Naturstoffe auch (Proteine, Saccharide, insbesondere Cellulose).
Unsere Welt ist ohne Kunststoffe heute nicht mehr vorstellbar. Doch was genau ist eigentlich ein Kunststoff? Kunststoffe bestehen aus sehr großen Molekülen (Makromolekülen), so wie viele Naturstoffe auch (Proteine, Saccharide, insbesondere Cellulose).Das Geodreieck besteht aus einem Kunststoff, der Polystyrol (PS) heißt und vollsynthetisch hergestellt wird, wo also die Ausgangsstoffe keine Naturstoffe sind.
Medikamentenkapseln sehen vom Material her doch sehr ähnlich aus. Auch ein Kunststoff? Nein. Die Umhüllung des Medikaments besteht - jedenfalls in den meisten Fällen - aus Gelatine, also aus einem Gemisch von tierischen Proteinen.
Im Wort Kunststoff steckt künstlich drin. Kunststoffe sind also künstlich hergestellte Makromoleküle. Es scheint so gesehen nicht verwunderlich, dass die ersten bedeutsamen Kunststoffe aus Naturstoffen hergestellt wurden (halbsynthetisch) und später, nachdem man die Struktur der Makromoleküle verstanden hat, auch vollsynthetische Kunststoffe hergestellt werden konnten.
Heute ist man in der Lage für fast jede Anwendungsbedingungen Kunststoffe zu synthetisieren:
Chirurgisches Nahtmaterial, das sich nach einer bestimmten Zeit im Körper rückstandslos auflöst, splitterfreie Brillengläser, Kontaktlinsen, Herzklappen aus Kunststoff, Windeln, die unglaublich viel Flüssigkeit aufnehmen können, ein Fahrradhelm, der viel mechanische Energie bei einem Sturz absorbieren kann und damit den Kopf optimal schützt, Sportbekleidung, die winddicht, atmungsaktiv und wasserabweisend ist, aber Schweiß nach außen transportiert, die sterile Spritze aus Kunststoff, ca. 100 Kg Kunststoff in einem Durchschnittsauto mit bedarfsabgestimmten Eigenschaften, die zerreisfeste Plastiktüte des Discounters, usw. usw.
In diesem Kapitel erfahren Sie
- von der spannenden Geschichte wie sich die Kunststoffe entwickelt haben
- welcher Zusammenhang zwischen der Struktur eines Kunststoffes und den spezifischen Eigenschaften dieses Kunststoffes besteht
- wie man gezielt Kunststoffe herstellt
- welche gesellschaftlichen, wirtschaftlichen und umweltpolititschen Probleme durch den Kunststoffabfall entstehen und wie man sie heute versucht zu lösen.
Nötige Vorkenntnisse

Nötige Vorkenntisse - Links
-
Funktionelle Gruppen: Hydroxy-Gruppe, Carboxy-Gruppe, Amino-Gruppen,
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links-
Ich kann die stukturellen Unterschiede zwischen den Kunststoffklassen Thermoplaste, Duroplaste und Elastomere erläutern und daraus die Eigenschaften dieser Kunststoffklassen beschreiben und erklären.
- Ich kann wichtige Vertreter der Kunststoffklassen nennen und deren Verwendungsmöglichkeiten im Alltag beschreiben.
- Ich kann die drei prinzipiellen Synthesearten (Polykondensation, Polymerisation und Polyaddition) mit Hilfe von Reaktionsschemata beschreiben.
externe Links
 Externe Links
Externe Links- Deutsches Kunststoff Museum, am 04.05.14 aufgerufen
- The Plastics Portal (www.plasticseurope.de), am 04.05.14 aufgerufen
- Kunststoffe, Freie Universität Berlin, am 04.05.14 aufgerufen
- Kunststoffe.de vom Hansaverlag, am 07.06.15 aufgerufen
-
Basiswissen
(1)
Chemie am Menschen - Kunststoffe

Orientierung Basiswissen
-
Entwicklung der Kunststoffe
(16)
Chemie am Menschen - Kunststoffe

Basiswissen Entwicklung der Kunststoffe
-
Struktur und Eigenschaften
(2)
Chemie am Menschen - Kunststoffe

Entwicklung der Kunststoffe Struktur und Eigenschaften
-
Thermoplaste
(5)
Chemie am Menschen - Kunststoffe

Struktur und Eigenschaften Thermoplaste
-
Duroplaste
(0)
-
Elastomere
(0)
-
Synthesen
(3)
Chemie am Menschen - Kunststoffe

Elastomere Synthesen
- Biologisch abbaubare Kunststoffe (1)
-
Farbmittel und Textilien
(0)
-
Gundkurs 3. HJ || Von chemischen Reaktionen zu Wärme und Strom
(0)
Von chemischen Reaktionen zu Wärme und Strom


 Chemische Reaktionen sind mit Energieumsätzen verbunden, die sich der Mensch zunutze machen kann: Durch chemische Reaktionen in einer Batterie entsteht elektrische Energie, Sprengstoffe können mechanische Arbeit verrichten, die Verwendung von Brennstoffen ist von gesellschaftspolitischer Bedeutung.
Chemische Reaktionen sind mit Energieumsätzen verbunden, die sich der Mensch zunutze machen kann: Durch chemische Reaktionen in einer Batterie entsteht elektrische Energie, Sprengstoffe können mechanische Arbeit verrichten, die Verwendung von Brennstoffen ist von gesellschaftspolitischer Bedeutung.Der Mensch braucht Energie um zu leben: Essen, Atmen und Arbeit sind dabei über chemische Reaktionen miteinander verknüpft. Wie wird diese Energie uns zur Verfügung gestellt?
Die Messung von Energieumsätzen liefert darüber hinaus auch wertvolle Informationen über die Eigenschaften und das Reaktionsverhalten von Stoffen.
-
Energetik
(0)

Orientierung
Einführung

Advanced Organizer
Energetik (die Energie betreffend) behandelt den Energieumsatz bei chemischen Reaktionen. Bisher haben wir uns im Hinblick auf chemische Reaktionen immer mit den Stoffumwandlungen selbst beschäftigt. Der energetische Aspekt wurde meistens lediglich mit der Kennzeichnung exotherm oder endotherm notiert.
Zum Gebiet der Energetik gehört auch die Frage, wann eine chemische Reaktion freiwillig abläuft ("Triebkraft" einer chemischen Reaktion).
Nötige Vorkenntnisse

Nötige Vorkenntisse - Links
-
Das Aufstellen von stöchiometrischen Reaktionsschematas.
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links- Im Unterricht wird vor allem geübt, aus Textinformationen Reaktionschemata aufzustellen, um hieraus Enthalpie-, Entropie- und freie Enthalpie-Berechnungen anstellen zu können. Es werden insbesondere Reaktionen besprochen, die einen Alltagsbezug aufweisen.
Fachbegriffe, Definitionen
Fachbegriffe, Definitionen
- Ich kann den Unterschied zwischen Wärme und Temperatur erklären.
- Ich weiß, was Energie prinzipiell vermag, kann unterschiedliche Arten von Energie und einige Umwandlungen nennen.
- Ich kann die Begriffe Reaktionsenergie, Reaktionswärme, Reaktionsenthalpie, Entropie erklären.
- Ich kann den 1. Hauptsatz und den 2. Hauptsatz der Thermodynamik nennen.
Phänomene
Gesetzmäßigkeiten anwenden, Phänomene deuten, Reaktionsschemata aufstellen (Summenformeln, Ionenformelschreibweise)
- Ich kann die Begriffe exotherm und endotherm anhand eines Energiediagrammes darstellen und erklären.
- Ich kann den Begriff Wärmekapazität erklären und mindestens ein Beispiel für einen Alltagsbezug herstellen.
- Ich kann betrachtete Reaktionen dem entsprechenden thermodynamischen System zuordnen.
- Ich kann in einem Energiediagramm für unterschiedliche Reaktionen den Zusammenhang zwischen innerer Energie, der Reaktionswärme bei konstantem Druck und der Volumenarbeit veranschaulichen.
- Ich kann unter Zuhilfenahme von entsprechender Tabellen molare Bildungsenthalpien und Reaktionsenthalpien (auch unter Verwendung des Satzes von Hess) berechnen.
- Ich kann durch Berechnung der freien Enthalpie (Gibbs-Helmholtz-Gleichung) eine Aussage über die Freiwilligkeit einer chemischen Reaktion bei bestimmten Temperaturen machen (exergonisch, endergonisch).
-
-
Redoxreaktionen
(0)

Orientierung

Einführung
Advanced Organizer
Die Begriffe Oxidation bzw. Reduktion wurden in der 10. Klasse als Abgabe bzw. Aufnahme von Elektronen definiert. Wenn Elektronen sich bewegen können, dann "fließt" Strom.
Nachdem in diesem Kapitel noch einmal die wichtigsten Zusammenhänge zum Thema Redoxreaktionen geklärt worden sind, soll die Umwandlung von chemischer Energie in elektrische Energie näher betrachtet werden. Solche Umwandlungen begegnen uns tagtäglich: Batterien, Akkus und Brennstoffzellen sind aus unserem Alltag nicht mehr wegzudenken.
Mit Hilfe von Strom lassen sich auch Elemente aus Verbindungen herstellen. Die Wasserzersetzung durch den Hofmannschen Zersetzungsapparat hast du schon in der 8. Klasse kennengelernt. Hierbei wurden Wasserstoff und Sauerstoff erzeugt. Wir werden am Beispiel der Aluminiumgewinnung ein großtechnisches Verfahren der Elektrolyse kennen lernen.
-
Oxidationszahlen
(2)

Oxidationszahlen

-
Elektrolyse (2)
(0)

Elektrolyse (2)

-
Oxidationszahlen
(2)
-
Energetik
(0)
-
Grundkurs 4. HJ || Von der Umkehrbarkeit chemischer Reaktionen zum chemischen Gleichgewicht
(0)
-
Kinetik - Orientierung
(1)
Kinetik

Orientierung
Einführung

Advanced Organizer
Während wir uns im letzten Unterrichtsblock mit der Energetik von chemischen Reaktionen beschäftigt haben, werden wir uns jetzt mit der Kinetik, also dem zeitlichen Ablauf von chemischen Reaktionen, auseinandersetzen.
Natürlich weiß jeder, dass Lebensmittel in der Sonne schneller verderben als im Kühlschrank. Aber woran liegt das? Warum reift ein Apfel so langsam? Und warum reift eine Banane schneller, wenn sie neben einem Apfel liegt? Warum ist das Rosten von Eisen ein langsamer Prozess und warum sind Reaktionen wie die Knallgasreaktion oder andere Explosionen schnelle Reaktionen? Was versteht man eigentlich genau unter dem Begriff Reaktionsgeschwindigkeit? Von welchen Faktoren hängt die Reaktionsgeschwindigkeit ab? Wie kann man Reaktionsgeschwindigkeiten messen?
Mit solchen Fragen werden wir uns in diesem Kapitel beschäftigen.
Die Katalyse gehört zu den Schlüsseltechnologien des 21. Jahrhunderts.
Katalysatoren sind Stoffe, welche die Aktivierungsenergie zum Ablauf einer bestimmten Reaktion herabsetzen und dadurch die Reaktionsgeschwindigkeit erhöhen, ohne bei der Reaktion verbraucht zu werden. Ein Katalysator geht (scheinbar) unverändert aus der Reaktion hervor.
Neben der Anwendung bei Kraftfahrzeugen zum Abbau von Schadstoffen steuern Katalysatoren heute schon mehr als 80% aller großtechnischen Prozesse in der chemischen Industrie. Da durch Katalysatoren die Aktivierungsenergie gesenkt wird, wird auch Energie eingespart und damit der Energieausstoß in die Umwelt geringer. Außerdem spielen Katalysatoren in der Natur, z.B. für die Energiegewinnung biologischer Prozesse, eine wichtige Rolle.
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - LinksZusammenfassung

Zusammenfassung - Links
- Als Reaktionsgeschwindigkeit bezeichnet man den Quotienten der Änderung der Konzentration eines Reaktionspartners und dem betrachteten Zeitintervall.
- Die Geschwindigkeit einer Reaktion ist nicht konstant, da sie konzentrationsabhängig ist. Spielen bei einer Reaktion Gase eine Rolle, so kann der Gasdruck auch Einfluss auf die Reaktionsgeschwindigkeit haben.
- Man kann die durchschnittliche Geschwindigkeit für ein Zeitintervall mit v = Δc(Produkte)/Δt angeben oder die Momentangeschwindigkeit zu einem bestimmten Zeitpunkt durch den Differenzialquotienten v = dc/dt. Von besonderer Bedeutung ist die Anfangsgeschwindigkeit einer chemischen Reaktion.
- Um Stoffkonzentrationen zu einem bestimmten Zeitpunkt einer Reaktion berechnen zu können, muss das Geschwindigkeitsgesetz der Reaktion experimentell ermittelt werden, also die Reaktionsordnung bestimmt werden.
- Die Halbwertszeit einer Reaktion ist die Zeit, nach der im Verlauf der chemischen Reaktion genau die Hälfte der ursprünglichen Stoffmenge umgesetzt wurde.
- Chemische Reaktionen finden statt, wenn die Teilchen mit genügend großer Energie in in einem bestimmten Winkel aufeinander stoßen (Stoßtheorie). Mit steigender Temperatur nimmt der Anteil an wirksamen Zusammenstöße zu. Daher steigt die Reaktionsgeschwindigkeit auch mit zunehmender Temperatur. Oft gilt, dass sich die Reaktionsgeschwindigkeit verdoppelt oder vervierfacht, wenn die Temperatur um 10 K erhöht wird (RGT-Regel).
- Die Reaktionsgeschwindigkeit ist von der Art des Stoffes abhängig. So reagieren unedle Metalle schneller mit Säuren, als edle Metalle.
- Die Reaktionsgeschwindigkeit ist von der Phasengrenzfläche bei heterogenen Ausgangsstoffen abhängig bzw. vom Zerteilungsgrad abhängig. Auch mechanische Faktoren wie z.B. der Effekt des Schüttels kann die Reaktionsgeschwindigkeit beeinflussen.
- Ein Katalysator erhöht die Reaktionsgeschwindigkeit durch Herabsetzung der Aktivierungsenergie und geht unverändert aus der Reaktion wieder hervor (daher wird er bei einem Reaktionsschema weder auf der Edukt-Seite noch auf der Produkt-Seite notiert, sondern über dem Reaktionspfeil).
-
Protolyse
(0)

Protolyse
-
Grundlagen der Protolyse
(1)

Grundlagen der Protolyse
 Protolysereaktionen sind chemische Reaktionen, bei denen ein Proton (Wasserstoff-Ion, H+) zwischen zwei Reaktionspartnern übertragen wird.Die Grundlagen zur Brønsted-Theorie wurden schon im Mittelstufenunterricht behandelt. Sie sollten an dieser Stelle noch einmal wiederholt werden. Link
Protolysereaktionen sind chemische Reaktionen, bei denen ein Proton (Wasserstoff-Ion, H+) zwischen zwei Reaktionspartnern übertragen wird.Die Grundlagen zur Brønsted-Theorie wurden schon im Mittelstufenunterricht behandelt. Sie sollten an dieser Stelle noch einmal wiederholt werden. Link - Autoprotolyse des Wassers (1)
-
pH-Wert
(0)
-
Grundlagen der Protolyse
(1)
-
Kinetik - Orientierung
(1)
-
Videos
(1)
Videos

Hier findet ihr eine Sammlung von ausgewählten Videos rund um die Chemie.
- Alle verfügbaren Tests (6)
-
Allgemeines
(2)
- Über mich (1)
-
Links
(0)
-
Spezielles
(0)
-
Spezielles
(0)
- Impressum (1)
- Kontakt (1)
- Periodensystem der Elemente (PSE) (4)
- Datenschutz (1)
- Warnhinweise (1)
- Menue1 (2)
- Einführung (1)
- Zitate / Anregungen / Tipps (23)
- Home (2)
- Wozu Chemie? (9)
-
AGB
(3)
- Passwort (1)
- Datenschutz (1)
- Besonderheiten für Online-Produkte (1)
- Lieferung, Versand- und Lieferkosten (1)
- Widerrufsrecht (1)
- Eigentumsvorbehalt (1)
- Gewährleistung, Haftung (1)
- Copyright (1)
- Tipps (2)














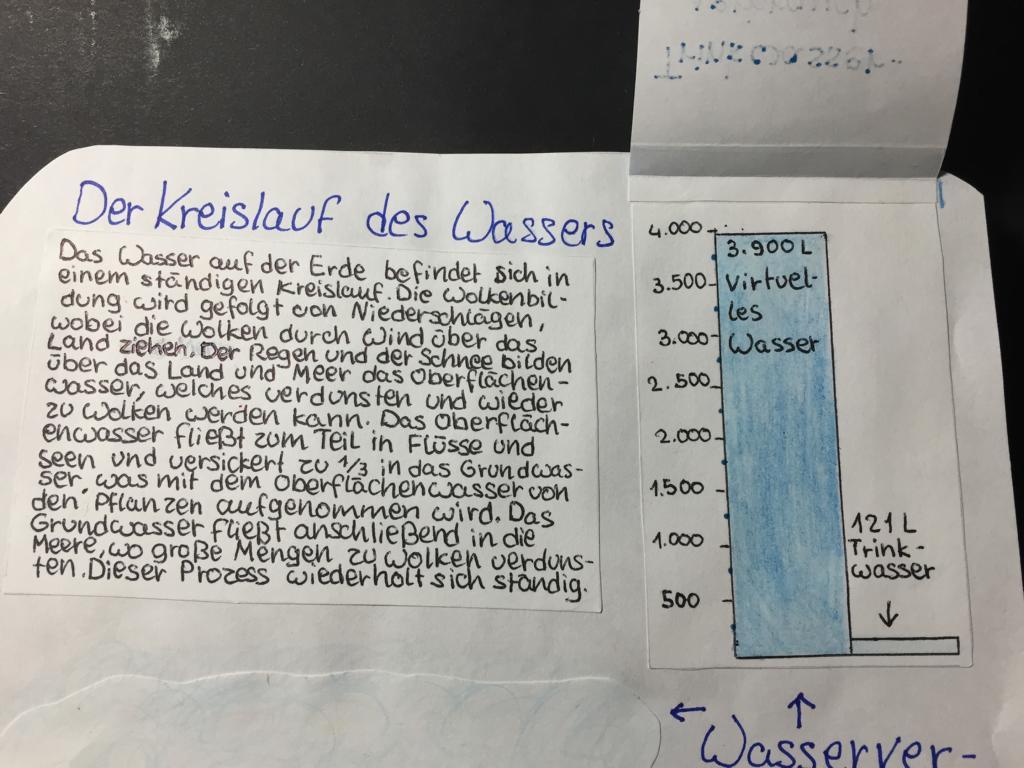





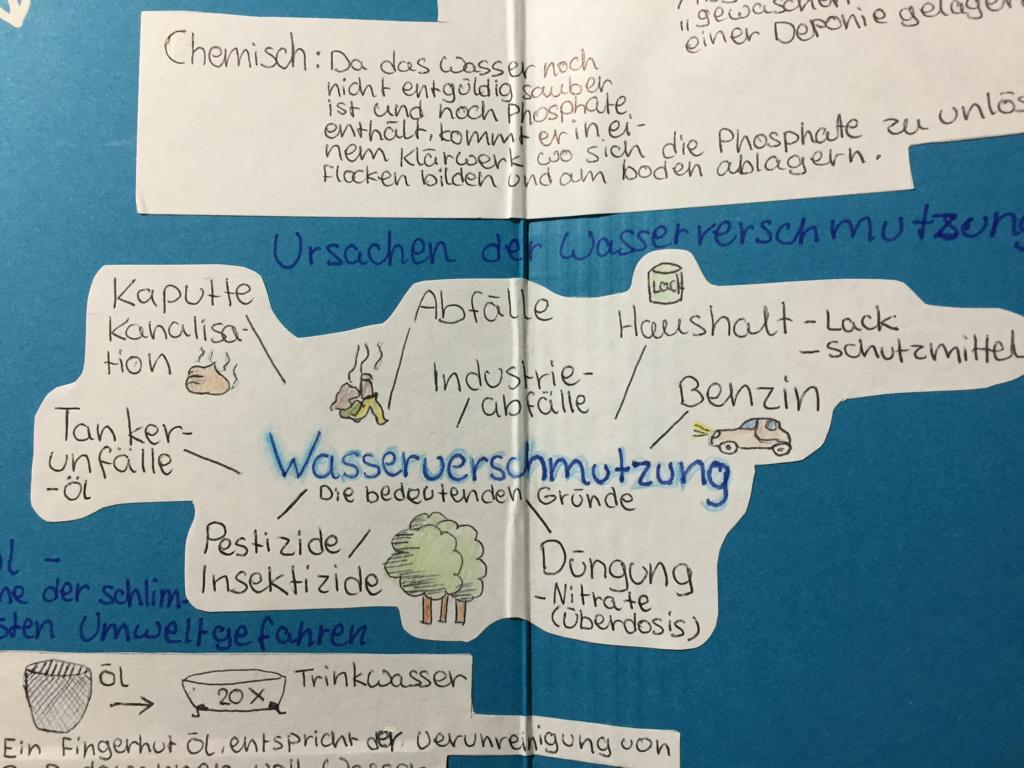






















 Ein Ester entsteht, wenn man eine Carbonsäure mit einem Alkohol reagieren lässt. Bei dieser Reaktion wird ein Wassermolekül abgespalten (Kondensationsreaktion). Die Synthese ist nur in Gegenwart von Protonen (der Schwefelsäure), die als Katalysator wirken, möglich.
Ein Ester entsteht, wenn man eine Carbonsäure mit einem Alkohol reagieren lässt. Bei dieser Reaktion wird ein Wassermolekül abgespalten (Kondensationsreaktion). Die Synthese ist nur in Gegenwart von Protonen (der Schwefelsäure), die als Katalysator wirken, möglich.